Школа по плазмохимии для молодых ученых России и стран СНГ
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
ПАРАМЕТРЫ ПЛАЗМЫ И ТРАВЛЕНИЕ МАТЕРИАЛОВ В СМЕСЯХ ХЛОРА С ИНЕРТНЫМИ И МОЛЕКУЛЯРНЫМИ ГАЗАМИ
Светцов В.И., Ефремов А.М.
Ивановский государственный химико-технологический университет
Известно, что разбавление хлора инертными газами при сохранении постоянным общего давления смеси не только не приводит к заметному уменьшению скорости травления, но в ряде случаев и вызывает увеличение последней [1-3]. Качественно эффект одинаков для всех инертных газов (He, Ar, Xe) и сохраняется при содержании хлора в смеси от 100 до 10 %. Несомненно, что такое явление имеет большие технологические перспективы, так как позволяет реализовать малые расходы газа-реагента и обеспечить технологически и экологически чистый процесс. В качестве основной причины, обуславливающей такой эффект, в литературе обсуждается, а иногда и принимается за аксиому, механизм ускорения генерации атомов хлора за счет диссоциации молекул при столкновениях с метастабильными атомами инертных газов. Такие процессы энергетически вполне возможны, так как и энергия разрыва связи в молекуле Cl2 (2.5 эВ) и энергия вертикального перехода при возбуждении нижних состояний молекулы хлора (порядка 3.2-3.4 эВ) много меньше, чем энергия любого метастабильного атома аргона. Поэтому целью данной работы являлось исследование механизмов взаимодействия плазмы смесей хлора с инертными (Ar) и молекулярными (N2, O2, H2) газами с металлами (Cu) и полупроводниками (Si, GaAs) и определение возможности спектрального контроля за ходом процесса травления. Выбор молекулярных добавок для наших иследований также не случаен и связан с тем, что в присутствии кислорода возможно образование промежуточных оксидных хлорсодержащих соединений [4], а для азота и водорода характерно наличие колебательно- и электронно - возбужденных молекул, столкновения которых с молекулами хлора могут приводить к диссоциации последних.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Исследования проводились в стеклянном плазмохимическом реакторе проточного типа при возбуждении тлеющего разряда поситоянного тока и расположении обрабатываемого материала в зоне положительного столба разряда . Хлор получали термическим разложением бихлорида меди в вакууме [5], давление и поток газа измеряли U-образным масляным манометром и реометром. Измерение температуры газа (Т) проводили методом двух термопар разного диаметра [6], напряженность электрического поля на оси разряда (Е) находили из зондовых измерений [6]. Для определения степени диссоциации (a ) молекул хлора в разряде использовался метод абсорбционной спектроскопии [7], погрешность которого в области малых парциальных давлений Cl2, по нашим оценкам, может достигать 30%. Общее давление плазмообразующей смеси во всех экспериментах составляло 100 Па, плотность тока 4.5 мА/см2, что соответствовало удельной мощности, вкладываемой в разряд, порядка 0.3 Вт/см3. При определении приведенной напряженности электрического поля (E/No) и концентраций нейтральных невозбужденных компонентов радиальное распределение температуры не учитывалось, а использовалась величина Т0.5R, усредненная по методике [6] на 0,5R (R - радиус реактора):
No = Р/(k.T0.5R) (1)
[Cl2] = (1-a )(1-g ) No (2)
[Cl] = 2a (1-g ) N 0 (3)
[X] = g N 0 (4)
где Nо - начальная общая концентрация частиц в реакторе, g и [X] - доля газа-добавки в исходной смеси и абсолютная концентрация в плазме, соответственно. Экспериментальные данные по степени диссоциации, температуре газа и приведенной напряженности поля в смесях переменного состава приведены в табл.1
Таблица 1
Cl2 - Ar |
Cl2 - O2 |
Cl2 - N2 |
Cl2 - H2 |
|||||||||
g |
E/N, 10-15 В см2 |
Тг, К |
a |
E/N, 10-15 В см2 |
Тг, К |
a |
E/N, 10-15 В см2 |
Тг, К |
a |
E/N, 10-15 В см2 |
Тг, К |
a |
0.1 |
2.58 |
448 |
0.317 |
2.44 |
454 |
0.309 |
2.52 |
461 |
0.302 |
2.44 |
472 |
0.304 |
0.2 |
2.37 |
446 |
0.352 |
2.31 |
458 |
0.331 |
2.42 |
461 |
0.317 |
2.50 |
472 |
0.312 |
0.3 |
2.08 |
444 |
0.404 |
2.22 |
460 |
0.371 |
2.37 |
458 |
0.331 |
2.51 |
472 |
0.335 |
0.4 |
1.83 |
442 |
0.473 |
2.16 |
460 |
0.433 |
2.35 |
455 |
0.348 |
2.46 |
472 |
0.349 |
0.5 |
1.62 |
440 |
0.549 |
2.10 |
460 |
0.521 |
2.34 |
454 |
0.364 |
2.49 |
472 |
0.360 |
0.6 |
1.50 |
438 |
0.633 |
2.04 |
459 |
0.626 |
2.33 |
454 |
0.392 |
2.23 |
472 |
0.389 |
0.7 |
1.40 |
436 |
0.738 |
1.98 |
458 |
0.743 |
2.28 |
453 |
0.431 |
1.67 |
472 |
0.433 |
0.8 |
1.28 |
434 |
0.851 |
1.87 |
456 |
0.860 |
2.20 |
452 |
0.500 |
1.30 |
472 |
0.510 |
0.9 |
1.00 |
432 |
0.980 |
1.74 |
453 |
0.980 |
2.06 |
452 |
0.608 |
1.25 |
472 |
0.612 |
Для определения коэффициентов скоростей процессов при электронном ударе и характеристик заряженной компоненты плазмы использовалось математическое моделирование разряда на основе совместного решения кинетического уравнения Больцмана и уравнений химической кинетики образования и гибели нейтральных и заряженных частиц в квазистационарном приближении. При этом концентрации заряженных компонент плазмы (электронов и ионов обоих знаков) могут быть найдены из решения следующей системы уравнений:
Гион = Гдп + DеNе (6)
Гион = Кii Ne b 2 + Dib (7)
Гдп = Кii Ne b 2 (8)
j = e E Ne (m e + b (m + + m -)) (9)
где Гион и Гдп - суммарные скорости ионизации и диссоциативного прилипания, которые могут быть вычислены как:
Гион =КиI(1-a )(1-g )N0 +КиII (1-g )2a N0+КиIIIg N0 (10)
Гдп =КиI(1-a )(1-g )N0 +КдпIIIg N0 (11)
Ne - концентрация электронов, b - относительная концентрация отрицательных ионов (b =N-/ Ne), Кii - усреднённая константа скорости ион-ионной рекомбинации, Ки и Кдп - константы скоростей ионизации и диссоциативного прилипания для молекул Cl2 (I), атомов хлора (II) и молекул газа - добавки (III). Заложенные в модель наборы элементарных процессов для атомов и молекул хлора ранее были неоднократно опробованы при моделировании плазмы индивидуальных газов по данной методике [8,9], которое показало удовлетворительную сходимость расчетных величин интегральных и кинетических характеристик электронов с данными, получаемыми в независимых экспериментах [8]. Сечения процессов брали из работ [10, 11]. Скорость травления измеряли гравиметрическим методом, путем взвешивания образцов до и после обработки на аналитических весах с точностью ± 5x 10-4 г. Запись спектров излучения разряда осуществлялась с помощью решеточного монохроматора МУМ с фотоэлектрической системой регистрации сигнала в диапазоне длин волн 200-800 нм.
ЗАКОНОМЕРНОСТИ ОБРАЗОВАНИЯ АТОМОВ ХЛОРА
Прямая диссоциация молекул Cl2 в смесях
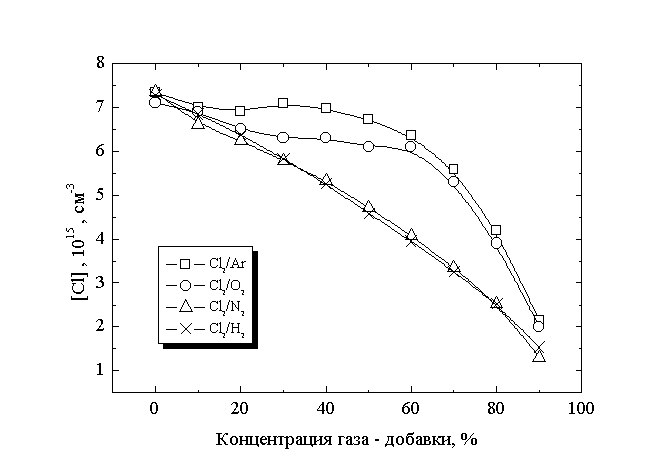
В табл.1 приведены данные по зависимости приведенной напряженности поля, степени диссоциации и температуры газа от состава смеси. Во всех исследованных смесях наблюдается рост степени диссоциации при увеличении концентрации добавки, причем характер изменения этой величины количественно близок для смесей хлора с аргоном и кислородом и менее быстрый для смесей Cl2 - N2 и Cl2 - Н2 . Изменение концентраций атомов и молекул хлора в смесях переменного состава, приведенное на рис.1, показывает, что для смесей Cl2 - Ar и Cl2 - O2 концентрация атомов хлора остается практически неизменной при увеличении концентрации газа-добавки до 50%, а характер изменения этой величины во всем диапазоне концентраций газов-добавок не коррелирует с характером изменения концентрации молекул хлора.

Рис.1
Зависимость концентрации атомов хлора от состава смеси
В плазме смесей хлора с азотом и водородом концентрация атомов во всем диапазоне изменения состава монотонно уменьшается, однако относительный ход этой зависимости также количественно не коррелирует с изменением концентрации исходных молекул Cl2. Очевидно, что причиной наблюдаемых эффектов может служить увеличение скорости объемной генерации атомов хлора или уменьшение вероятности их гетерогенной рекомбинации при разбавлении хлора инертной или молекулярной добавкой. Рассмотрим подробнее предложенные механизмы.
Известно, что образование атомов хлора в объеме происходит преимущественно в результате диссоциативного возбуждения нижних электронных состояний молекул Cl2 при электронном ударе [8]. Вклад диссоциативного прилипания в этот процесс для плазмы чистого хлора не превышает 5% в широком диапазоне условий (20 - 400 Па). Расчеты коэффициентов скоростей соответствующих процессов показали, что этот вывод сохраняется и для плазмы смесей хлора со всеми указанными газами. Таким образом, целесообразно рассмотреть влияние газов-добавок на закономерности прямой диссоциации молекул Cl2. Как показано в табл.1 добавка к хлору всех упомянутых газов приводит к уменьшению приведенной напряженности электрического поля. Для смесей хлора с азотом и кислородом константа скорости диссоциации Cl2 прямым электронным ударом мало чувствительна к этому параметру (6.54x 10-9 - 5.9x 10-9 см3/сек и 5.07x 10-9 - 3.3x 10-9 см3/с, соответственно, при изменении концентраций газов-добавок от 3% до 97%) из-за того, что пороговая энергия процесса (~ 4 эВ) меньше средней энергии электронов в разряде (8 - 12 эВ). Некоторый рост концентрации электронов при уменьшении приведенной напряженности электрического поля не компенсирует уменьшения концентрации молекул хлора в смесях, и скорость диссоциации монотонно уменьшается во всем диапазоне состава смеси. Соответствующие данные представлены на рис.2.
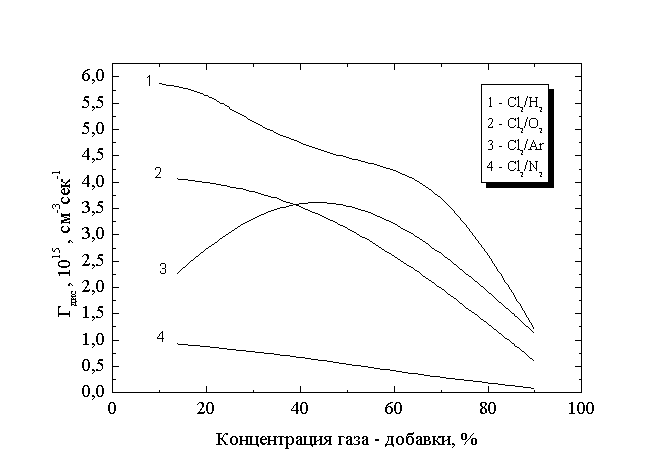
Рис.2
Зависимость скорости прямой диссоциации молекул Cl2 от состава смеси
Расчеты показали, что для смесей хлора с аргоном и водородом характер изменения скорости дрейфа и средней энергии электронов не коррелирует с изменением приведенной напряженности электрического поля. Этот факт достаточно очевиден поскольку данные газы "прозрачны" для электронов вплоть до первого потенциала возбуждения. Увеличение средней энергии электронов и доли быстрых электронов в функции распределения их по энергиям при разбавлении приводит к возрастанию коэффициента скорости прямой диссоциации молекул Cl2 (4.5x 10-9 - 8.9x 10-9 см3/сек для плазмы смеси Cl2 - Ar и 5.6x 10-9 - 6.5x 10-9 см3/сек для плазмы смеси Cl2 - Н2). При этом скорость диссоциации (рис.2) в смеси Cl2 - Н2 снижается менее чем на 12% при 50% разбавлении, а зависимость скорости диссоциации от содержания аргона носит экстремальный характер с максимумом при 40 - 50% концентрации инертного газа.
Таким образом, для смесей хлора с аргоном и водородом увеличение концентрации газа - добавки вызывает относительный рост скорости генерации атомов по механизму диссоциации прямым электронным ударом за счет изменения электрофизических параметров разряда.
Ступенчатая диссоциация молекул Cl2
Известно, что в смесях хлора с инертными и молекулярными газами возможно увеличение скорости генерации атомов в объеме плазмы за счет появления каналов ступенчатой диссоциации при взаимодействии молекул Cl2 с возбужденными частицами газов – добавок. Как уже отмечалось выше, в литературе присутствует обсуждение данного эффекта применительно к плазме смеси хлор-аргон, где диссоциация Cl2 при взаимодействии с метастабильными атомами аргона Ar(3P0,3P1,3P2) рассматривается в качестве объяснения постоянства скорости травления при разбавлении хлора инертным газом [2]:
Cl2 + Ar(3P0,3P1,3P2) ® Cl + Cl + Ar (12)
Энергетически реакция (12) является возможной, т.к. энергия метастабильного атома 11.9 эВ превышает как энергию разрыва связи в молекуле хлора 2.5 эВ, так и энергию вертикального перехода при возбуждении нижних диссоциирующих состояний. Расчеты показывают, что при изменении концентрации аргона в смеси от 10% до 90% концентрация метастабильных атомов Ar(3P0,3P1,3P2) лежит в диапазоне (0.19 – 72.5)x 109 см-3. При этом скорость образования метастабильных атомов аргона значительно ниже скорости диссоциации Cl2 прямым электронным ударом, что обусловлено существенным различием в пороговых энергиях соответствующих процессов при близких сечениях в максимуме ФРЭЭ. Решение балансных уравнеий химической кинетики образования и гибели метастабильных атомов Ar(3P0,3P1,3P2) с использованием литературных данных по коэффициентам скоростей процессов [12] позволяет заключить, что в рассматриваемой системе реакция (12) является преимущественным каналом тушения метастабильных состояний аргона, однако скорость ее также ниже скорости прямой диссоциации. Данные, представленные в табл.2 позволяют сделать вывод о назначительности вклада ступенчатой диссоциации по механизму (12) в общую скорость объемной генерации атомов хлора в плазме смеси Cl2 – Ar.
Таблица 2
[Ar], % |
10 |
30 |
50 |
70 |
90 |
Гдис(Cl2), 1015,см-2с-1 |
1,98 |
3,53 |
3,75 |
2,74 |
1,12 |
Г12, 1015,см-2с-1 |
0,06 |
0,11 |
0,25 |
0,57 |
2,6 |
Отношение скоростей |
0.03 |
0.03 |
0.07 |
0.21 |
2.30 |
Из вторичных процессов в плазме смеси хлора с кислородом, на наш взгляд, наиболее существенными являются, например:
O2 + Cl ® O + ClO (13)
Cl2 + O ® Cl + ClO (14)
Cl2 + O2(A3S +u) ® Cl + Cl + O2(X3S -g) (15)
Реакция (13) маловероятна из-за того, что обладает достаточно большой для "тяжелых" частиц пороговой энергией порядка 0.6 эВ. Реакция (14) энергетически возможна и скорость ее будет определяться скоростью диссоциации молекул кислорода. Возможна также и дальнейшая диссоциация молекул ClO под действием электронного удара с регенерацией атомов кислорода и их участием в реакции (14). Строгий количественный учет этого вклада затруднен из-за отсутствия данных по сечению диссоциации молекул ClO, однако приближенно он может быть оценен введением коэффициента "2" перед скоростью диссоциации молекул кислорода прямым электронным ударом. Расчеты показали, что в диапазоне концентраций кислорода в смеси до 70% скорость диссоциации молекул О2 по крайней мере на два порядка величины меньше скорости диссоциации молекул хлора прямым электронным ударом. Поэтому даже в предположении, что все образующиеся в разряде атомы кислорода будут расходоваться на диссоциацию хлора по реакции (14) , вклад этого процесса в образование атомов хлора не может превышать 10% от прямого механизма во всем диапазоне состава смеси. Аналогичный вывод можно сделать и о реакции (15), скорость которой определяется скоростью возбуждения метастабильного состояния O2(A3S +u). Расчеты показзывают, что в диапазоне состава смеси до 30% O2 скорость прямой диссоциации примерно на порядок величины превышает скорость возбуждения O2(A3S +u). При этом в рамках оценки “сверху”, предполагая, что все образующиеся в разряде метастабильные молекулы O2(A3S +u) гибнут по реакции (15), вклад данного процесса становится сравнимым с прямой диссоциацией при концентрации кислорода в смеси более 75%. Поэтому, с учетом существования других каналов гибели метастабильных молекул кислорода, влиянием ступенчатой диссоциации по механизму (15) на образование атомов хлора в объеме плазмы можно пренебречь. Соответствующие данные представлены в табл. 3 (y – мольная доля компонента смеси).
Таблица 3
[O2], % |
10 |
30 |
50 |
70 |
90 |
y(Cl2) x Kдис(Cl2) |
2.62x 10-9 |
2.40x 10-9 |
2.00x 10-9 |
1.29x 10-9 |
0.36x 10-9 |
y(O2) x Kв(A3S +u) |
0.10x 10-9 |
0.31x 10-9 |
0.74x 10-9 |
1.25x 10-9 |
1.71x 10-9 |
Отношение скоростей |
0.04 |
0.13 |
0.37 |
0.97 |
4.75 |
Следовательно, вторичные объемные процессы в плазме смеси хлора с кислородом не объясняют наблюдаемой экспериментально зависимости концентрации атомов хлора от состава смеси.
При анализе вторичных процесов в плазме смеси Cl2 - N2 необходимио учитывать возможность ступенчатой диссоциации молекул хлора при их взаимодействии с колебательно - возбужденными (16) и метастабильными (17) молекулами молекулами N2:
N2*(v> 8) + Cl2 ® N2+ Cl + Cl (16)
N2*( A3S u+) + Cl2 ® N2(X1S g+) + Cl + Cl (17)
Величина энергии разрыва связи в молекуле хлора составляет 2.5 эВ, что значительно превышает величину колебательного кванта молекулы азота 0.29 эВ [13]. Очевидно, что в процессе ступенчатой диссоциации могут участвовать только молекулы N2, находящиеся на высоких колебательно-возбужденных уровнях (v>8). Расчеты показывают, что в предположении о триноровском распределении колебательно-возбужденных молекул азота, концентрация возбужденных молекул с энергией, превышающей энергию разрыва связи Cl2, составляет 1.7x 1011 - 1.6x 1012 см-3 при изменении содержания азота в смеси от 10% до 90%. Данные по коэффициентам скоростей релаксации колебательно-возбужденных молекул азота на молекулах Cl2 в литературе отсутствуют, а типичное максимальное значение этой величины для большинства двухатомных молекул составляет порядка 5x 10-13 см3/сек [13]. Следовательно, скорость этого процесса в том же диапазоне состава может изменяется от 8.8x 1014 см-3сек-1 до 1.7x 1015 см-3сек-1. Сравнение этих данных со скоростью диссоциации молекул хлора прямым электронным ударом показывает, что, даже в рамках оценки "сверху", вклад ступенчатой диссоциации (16) по сравнению с прямым механизмом не может превышать 6% и этот процесс не объясняет наблюдаемой экспериментально зависимости концентрации атомов хлора от состава смеси.
Величина свободной энергии состояния N2( A3S u+) составляет порядка 6 эВ, а больное время жизни (до 12 сек) позволяет этим частицам эффективно взаимодействовать с нейтральными компонентами плазмы. Расчеты показывают, что при содержании азота в смеси более 70% скорости процессов образования N2(A3S u+) становятся соизмеримы со скоростью прямой диссоциации молекул хлора. Поэтому в рамках оценки “сверху” можно предположить появление дополнительного канала диссоциации молекул Cl2 по механизму (13), вносящего вклад в общую скорость объемной генерации атомов хлора в разряде. Однако, с учетом гибели метастабильных молекул в других объемных и гетерогенных процессах, максимальный вклад реакции (17) в диссоциацию Cl2 составляет 35% при 90% содержании азота в смеси. Таким образом, в плазме смеси хлора с азотом ни один из рассмотренных ступенчатых процессов не способен дать существенного вклада в общую скорость объемной генерации атомов хлора.

Рис.3
Вклад процессов ступенчатой диссоциации в образование атомов хлора в
смеси с водородом: 1 - реакция (18), 2 - реакция (19)
При анализе процессов вторичной диссоциации Cl2 в плазме смеси с водородом следует отметить возможность появления каналов ступенчатой диссоциации при взаимодействии молекул хлора с метастабильными атомами H(2S) и колебательно-возбужденными молекулами H2*(v > 5):
Cl2 + H(2S) ® Cl + Cl + H (18)
Cl2 + H2*(v>5) ® Cl + Cl + H2 (19)
Расчеты показывают, что в рассматриваемом диапазоне условий максимальная величина константы скорости возбуждения метастабильных атомов H(2S) составляет 8.5x 10-10 см3/сек, что существенно ниже константы скорости прямой диссоциации Cl2 из-за большого различия в пороговых энергиях процессов (10 эВ и 2.5 эВ, соответственно). Концентрация атомов водорода в исследуемой смеси ниже концентраций других нейтральных частиц и составляет 1.50x 1014 - 1.38x 1015 см-3 , а скорость возбуждения метастабильных атомов изменяется от 2.04x 1013 см-3сек-1 при 10% содержании водорода до 6.22x 1014 см-3сек-1 при 90% концентрации газа-добавки. Представленное на рис.3 отношение скоростей возбуждения метастабильных атомов и прямой диссоциации Cl2 показывает, что даже в рамках оценки “сверху” вклад реакции (18) в диссоциацию молекул Cl2 не превышает 1% при содержании водорода до 50% и достигает максимального значения 33% при 90% содержании водорода в смеси. Расчеты концентрации колебательно-возбужденных молекул H2*(v > 5) в предположении о триноровском распределении по уровням колебательной энергии дают величину порядка 5x 1013 см-3. Принимая во внимание, что характерное значение константы скорости колебательной релаксации этих частиц на молекулах хлора составляет 8x 10-14 см3/сек [13], влиянием реакции (19) на диссоциацию молекул Cl2 также можно пренебречь. Данный вывод иллюстрируется отношением скоростей рассматриваемых процессов, представленным на рис.3. Следовательно, с достаточной степенью уверенности можно утверждать, что в плазме смеси хлор - водород процессы ступенчатой диссоциации неэффективны по сравнению с прямым механизмом при электронном ударе.
Таким образом, проведенный выше анализ процессов ступенчатой диссоциации молекул хлора при их взаимодействии с возбужденными частицами газов - добавок показал, что данные процессы неэффективны ни в одной из исследованных смесей. При этом, не зависимо от рода газа - добавки, основной вклад в общую скорость образованя атомов в объеме плазмы дает диссоциация Cl2 прямым электронным ударом.
ЗАКОНОМЕРНОСТИ ТРАВЛЕНИЯ МАТЕРИАЛОВ В ПЛАЗМЕ СМЕСЕЙ
Как уже отмечалось выше, в качестве материалов для исследования мы использовали медь (Cu), кремний (Si111) и арсенид галлия (GaAs). Выбор объектов исследования был обусловлен как модельными соображениями, так и широкой распространенностью данных материалов в технологии микроэлектроники.
Эксперименты показали, что для всех смесей, кроме Cl2 - O2, количество удаляемого с поверхности материала при постоянных внешних параметрах разряда и любом фиксированном составе смеси прямо пропорционально времени процесса, что указывает на первый кинетический порядок реакции по концентрации химически активных частиц в газовой фазе. Для смеси хлора с кислородом кинетические кривые травления всех указанных материалов имеют участок насыщениея при временах обработки более 10 мин, что объясняется образованием на поверхности оксидного слоя, препятствующего доступу активных частиц. При этом кинетические зависимости, соответствующие различным параметрам разряда и температурным условиям, удовлетворительно лианеризуются в координатах диффузионного уравнения D m/S ~ t 1/2. Такая ситуация является характерной для процессов, лимитируемых диффузией активных частиц через маскирующие поверхностные покрытия.
Температурные зависимости скоростей травления для всех систем удовлетворительно лианеризуются в аррениусовских координатах, причем все экспериментальные точки укладываются на единую для каждого материала зависимость. Абсолютые значения энергии активации не зависят от степени разбавления хлора газом - добавкой и составляют 0.49 Эв (47 КДж/моль) при травлении GaAs в плазме Cl2 - Н2 и Cl2 - Ar, 0.38 эВ (37 КДж/моль) при травлении Cu в плазме Cl2 - Ar, Cl2 - N2 , Cl2 - O2 и 0.52 эВ (50 КДж/моль) при травлении Si в плазме Cl2 - Ar, Cl2 - Н2. Согласно анализу литературных данных [14, 15] лимитирующей стадией процесса травления во всех случаях могут являться адсорбционно - десорбционные процессы на поверхности с участием как продуктов реакции, так и активных частиц.
Длительная (более 30 мин) выдержка всех материалов в атмосфере как чистого Cl2, так и смесей переменного состава при температурах более 200 оС без разряда не приводит к заметному взаимодействию для Si и GaAs. Это позволяет утверждать, что молекулярные компоненты смесей химически инертны по отношению к данным материалам, а основными активными частицами плазмы, обеспечивающими травление, являются атомы хлора. Данный вывод справедлив и для травления GaAs в плазме смеси Cl2 - Н2. Хотя известно, что арсенид галлия взаимодействует и с атомарным водородом, вклад этих частиц в общую скорость удаления материала невелик. Сравнение скоростей травления в плазме чистых газов показывает, что при одинаковых внешних условиях скорость взаимодействия в плазме чистого Cl2 более чем на порядок превышает величину для плазмы водорода (3.7x 10-3 г/см2мин и 3.2x 10-4 г/см2мин, соответственно, при Т = 100 0С). По нашему мнению, такое различие может быть обусловлено как более высокой вероятностью взаимодействия атомов хлора с исследуемым материалом, так и более высокими степенями диссоциации молекул Cl2. Напротив, медь эффективно взаимодействует с молекулярным хлором как в условиях чистого газа, таки в смесях. При этом скорости плазменного и термического процессов в чистом хлоре в одинаковых температурных условиях различаются не более чем на 10% (1.2x 10-4 г/см2сек и 1.0x 10-4 г/см2сек, соответственно при Т=563 К), указывая на близкие вероятности взаимодействия Cu с атомами и молекулами Cl2. Разбавление хлора любой инертной или молекулярной добавкой вызывает снижение скорости термического процесса пропорционально уменьшению концентрации молекул Cl2.
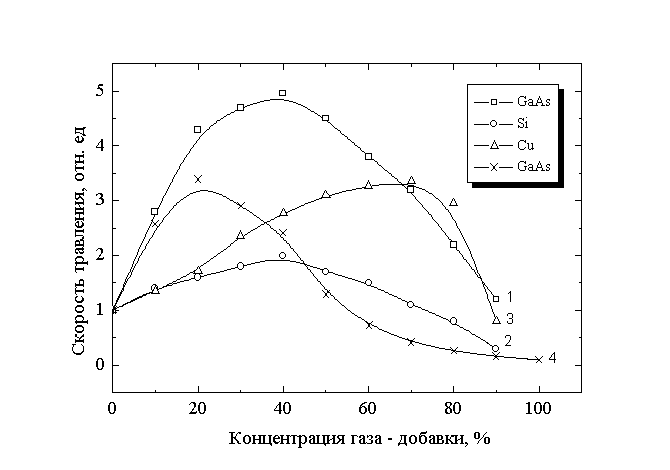
Рис.4
Зависимость скорости травления материалов от состава смеси.
1 - GaAs в Cl2 – Ar (полож. столб, 373 К), 2 - Si в Cl2 – Ar (катод, 673 К), 3 - Cu в Cl2 –Ar (полож. столб, 553 К), 4 - GaAs в Cl2 - Н2 (полож. столб, 393 К)
Эксперименты показали, что для плазмы смесей Cl2 - O2 и Cl2 - N2 увеличение концентрации газа - добавки при постоянной температуре и параметрах разряда вызывает снижение скорости взаимодействия со всеми объектами по закону, близкому к концентрационному эфеекту. В то же время, для смесей хлора с аргоном и водородом обнаружен эффект увеличения скорости взаимодействия с ростом содержания газа - добавки. Для плазмы смеси Cl2 - Ar данный эффект проявляется для всех исследованных материалов, а для плазмы Cl2 - Н2 - при травлении арсенида галлия, причем другие объекты не исследовались. Принимая во внимание, что увеличение содержания газа - добавки не вызывает роста скорости объемной генерации химически активных частиц - атомов хлора, причину роста скорости травления следует искать во влиянии состава смеси на гетерогенные стадии процесса травления, например, через увеличение вероятности взаимодействия. Проанализируем этот механизм на примере травления GaAs в плазме смесей Cl2 - Ar и Cl2 - Н2.
В табл.4 приведены зависимости вероятности взаимодействия атомов хлора с арсенидом галлия от состава смеси, которые были расчитаны по соотношению:
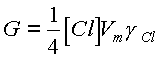 (20)
(20)
где G - скорость взаимодействия в пересчете на поток продуктов реакции с поверхности, Vm - среднеквадратичная скорость теплового движения активных частиц - атомов хлора, g Cl - вероятность взаимодействия. Абсолютное значение вероятности взаимодействия, на наш взгляд, очень велико и достигает при температуре 373 К (100 оС) значения 1.2x 10-2 для смеси хлор-аргон и 1.4x 10-2 (при Т=393 К) для смеси хлор-водород при максимально возможной величине 0.33. Последняя цифра соответствует образованию трихлоридов галлия и мышьяка как основных десорбируемых молекул [16]. В общем случае, среди возможных причин, способствующих такого рода изменениям вероятности взаимодействия следует рассматривать изменения температуры обрабатываемого материала или эффективности воздействия потоков активных частиц (метастабильных атомов, ионов, квантов УФ излучения), вызывающих очистку поверхностных активных центров. Эксперименты показали, что даже без термостатирования образца его температура при увеличении содержания аргона или водорода монотонно уменьшается, что должно вызывать уменьшение, а не рост скорости взаимодействия. Следовательно причину наблюдаемого эффекта следует искать в изменение эффективности воздействия потоков активных частиц.
Таблица 4
[Ar, H2], % |
10 |
30 |
50 |
70 |
90 |
g Cl в Cl2 - Н2 , Т=100оС |
5.04x 10-3 | 7.27x 10-3 | 3.57x 10-3 | 1.34x 10-3 | 1.23x 10-3 |
g Cl в Cl2 - Ar, Т=100оС |
Проведем анализ влияния состава смеси на скорость взаимодействия исходя из адсорбционно-десорбционной модели. В качестве активных центров можно рассматривать чистую поверхность материала или промежуточного соединения, способных присоединять хлор. Остальная поверхность, неактивная по отношению к химической реакции, приводит к рекомбинации атомов на поверхности без взаимодействия. При этом скорость реакции, протекающей в кинетическом режиме, пропорциональна потоку атомов, вероятности взаимодействия с активными центрами и доле последних:
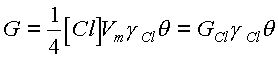 (21)
(21)
где q - степень заполнения активными центрами поверхности образца. Величина q определяется процессами взаимодействия плазмы с поверхностью: образование активных центров происходит в результате десорбции продуктов взаимодействия и нереагирующих частиц под действием нагревания, ионной бомбардировки, потоков метастабильных частиц, ультрафиолетового излучения и т.д., а гибель - при адсорбции нереагирующих частиц и в химических реакциях. Тогда балансное уравнение для степени заполнения можно записать в виде
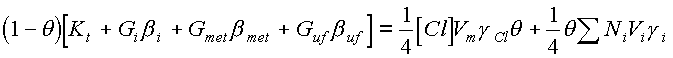 (22)
(22)
где Кt - коэффициент термической десорбции; Gi, Gmet, Guf - потоки на поверхность ионов, метастабильных атомов аргона и квантов УФ излучения, соответственно; Ni, Vi - концентрация и скорость теплового движения нереагирующих частиц, заполняющих активные центры с вероятностью g i; b - коэффициент пропорциональности, численно равный количеству активных центров, очищаемых при единичном акте взаимодействия частицы с поверхностью.
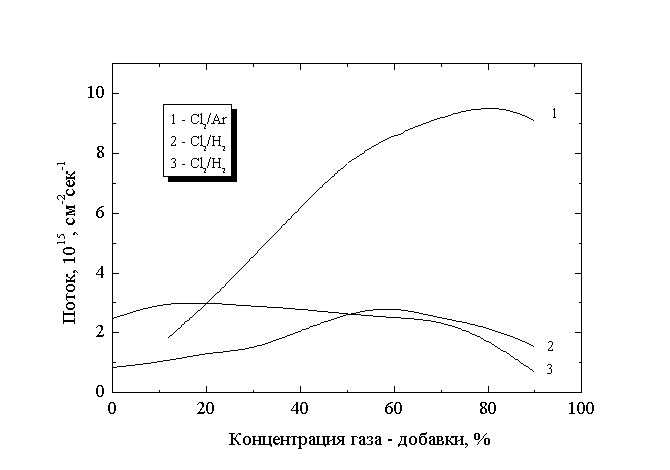
Рис.5
Зависимость потоков положительных ионов и квантов УФ излучения на поверхность образца от состава смеси:1 - положительные ионы в Cl2 - Ar, 2 - положительные ионы в Cl2 - H2, 3- УФ - кванты в Cl2 - H2
Сравнение потоков на поверхность частиц различных сортов показывает, что для обеих смесей потоки нейтральных возбужденных частиц, включая метастабильные атомы Ar(3P0,3P1,3P2) и H(2S), по крайней мере на 2 порядка величины ниже потоков положительных ионов и квантов собственного молекулярного УФ излучения хлора (256, 307 нм) и их влиянием на изменение вероятности взаимодействия можно пренебречь. Хотя абсолютная величина потока ионов в обоих случаях значительно ниже потока химически активных частиц, зависимость Gi от состава смеси носит экстремальный характер. Максимальное значение Gi для смесей в 10 (Cl2 - Ar) и 3.4 (Cl2 - H2) раза превышает величину для плазмы чистого хлора в аналогичных условиях. Соответствующие данные представлены на рис.5
Учесть вклад термической десорбции количественно не представляется возможным, однако очевидно, что в условиях термостатирования он не будет зависеть от состава плазмообразующей смеси. С другой стороны, высокие степени диссоциации молекул хлора в смесях и низкая адсорбционная способность частиц газов - добавок позволяют в первом приближении пренебречь влиянием адсорбции нереагирующих частиц на гибель активных центров. Таким образом, в предположении, что основным каналом образования активных центров является ионно-стимулированная десорбция, а гибели - химическая реакция уравнение (22) может быть преобразовано к виду:
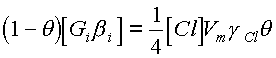 (23)
(23)
Решая (23) относительно q и подставляя результат в (21) получим:
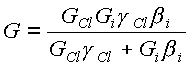 (24)
(24)
где все величины, кроме коэффициента ионно-стимулированной десорбции (b i) известны из эксперимента. Расчетные данные по коэффициенту ионно-стимулированной десорбции приведены в табл.5, полученные значения представляются достаточно разумными и хорошо согласуются с литературными данными [16].
Таблица 5
[Ar, H2], % |
10 |
30 |
50 |
70 |
90 |
b i в Cl2 - Н2 , Т=100оС |
2.78 |
3.53 |
0.35 |
0.04 |
0.02 |
b i в Cl2 - Ar, Т=100оС |
14.2 |
38.9 |
57.9 |
26.6 |
- |
Более того, характер изменения b i при разбавлении имеет хорошую качественную и количественную корреляцию с соответствующей зависимостью скорости травления для обеих смесей, что позволяет рассматривать ионно - стимулированную десорбцию в качестве основного механизма, обуславливающего увеличение скорости взаимодействия в смесях Cl2 - Ar и Cl2 - Н2. При этом наличие максимума на зависимости скорости травления от состава смеси может быть объяснено конкуренцией процессов увеличения числа свободных активных центров на поверхности и уменьшения объемной концентрации и потока химически активных частиц.
ЗАКЛЮЧЕНИЕ
Резюмируя вышесказанное можно отметить, что независимо от рода газа - добавки основным каналом образования атомов хлора в плазме смесей переменного состава является диссоциация прямым электронным ударом, скорость которой определяется влиянием состава смеси на электрофизические параметры разряда. Отмеченный для смесей Cl2 - Ar и Cl2 - Н2 рост скорости взаимодействия при разбавлении обусловлен влиянием состава смеси на гетерогенные стадии процесса, через увеличение его вероятности при интенсификации очистки поверхностных активных центров под действием ионной бомбардировки.
ЛИТЕРАТУРА
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |