Школа по плазмохимии для молодых ученых России и стран СНГ
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
ЭКЗОТЕРМИЧЕСКИЙ ЭФФЕКТ ПРИ ВОССТАНОВИТЕЛЬНОМ ПИРОЛИЗЕ ХЛОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Будрина Е.В., Десятков Г.А., Энгельшт В.С.
xlor@slavic.freenet.kg, gendes@slavic.freenet.kg
Институт физики Национальной Академии наук Киргизской Республики
Киргизско-Российский Славянский университет
Проблема ликвидации и переработки отходов производства - одна из важных задач современной промышленности. Значительная часть отходов приходится на долю химической промышленности, в том числе и ее хлоридной подотрасли. Отходы хлорорганических производств - винилхлорида, эпихлоргидрида, дихлорэтана и других продуктов - представляют собой трудноразделимую, а иногда и неразделимую смесь токсичных коррозионно-активных веществ.
В настоящее время известны следующие основные направления утилизации хлорорганических отходов: сжигание с получением хлористого водорода или соляной кислоты, пиролиз и исчерпывающее деструктивное хлорирование с получением трихлорэтилена, перхлорэтилена и четыреххлористого углерода [ 1] .
В последнее время все большее внимание уделяется исследованию пиролиза хлорорганических отходов, позволяющего получать безводный хлористый водород, хлорорганические и некоторые другие продукты [ 2] .
Восстановительный пиролиз также используется для уничтожения накопленных галогеносодержащих соединений, таких как озоноразрушающие хладоны. Известно, что хладоны не рекомендуется сжигать в воздухе, так как в этом случае образуются опасные кислородсодержащие вещества - диоксины и фосгены [ 3] . При переработке веществ, не содержащих кислород, желательно использовать бескислородные методы, к которым и относится восстановительный пиролиз [ 4] .
Многие из хлорорганических соединений термодинамически нестабильны и при их пиролизе выделяется энергия, т.е. наблюдается экзотермический эффект. Этот эффект известен и применяется на практике, при этом процесс идет автотермично [ 2,5] , способствуя инициированию пиролиза, начинающегося при 400-600оС [2,6].
Нам неизвестны систематические исследования экзотермического эффекта для хлорорганических соединений. Поэтому в данной работе проведены теоретические исследования термических характеристик равновесия хлорорганических соединений при восстановительном пиролизе. Для анализа были взяты все вещества, для которых в [7,8] приведена энтальпия образования, их комбинационные смеси с водородом, углеводородом и друг с другом. В таблице 1 приведены смеси, соединения и чистые вещества, конечными продуктами которых при полном разложении в стандартных условиях (Т=298К, р=0,1 МПа) являются конденсированный углерод (C*) и хлористый водород (HCl). Для оценки экзотермического эффекта использовалась адиабатическая температура Тад, которая получается при протекании пиролиза в закрытой системе. Эта температура рассчитывалась по программе ASTRA-4/pc [ 9] , которая позволяет найти температуру равновесия данной реакции по заданным теплоте образования вещества и давлению. Расчеты проводились без учета образования ионов при давлении 0,1 МПа и энтальпии образования газообразных веществ, взятой при температуре 298 К по литературным данным [ 7,8] . При анализе использовались не только вещества, существующие при стандартных условиях (Т=298 К), но и радикалы, которые образуются в экстремальных условиях. Как и ожидалось, адиабатическая температура оказалась достаточно высокой (~ 1500-3000 K) (см. табл.1).
Таблица 1
| № | Исходные вещества |
Тад, К |
Конечные вещества (Т=298К) |
Q(Т=298), кДж/ моль |
Q(Т=298), кДж/ моль HCl |
1 |
ССl + CH |
4045 |
2C* + HCl |
-1130 |
-1130 |
2 |
CCl + 0,5H2 |
3470 |
C* +HCl |
-532 |
-532 |
3 |
CHCl |
3330 |
C* + HCl |
-401 |
-401 |
4 |
CCl2 + CH2 |
3328 |
2C* + 2HCl |
-801 |
-401 |
5 |
CCl2 + H2 |
3000 |
C* + 2HCl |
-411 |
-204 |
6 |
CCl3 + CH3 |
2790 |
2C* +3HCl |
-503 |
-168 |
7 |
CH2Cl+ CHCl2 |
2720 |
2C* +3HCl |
-467 |
-156 |
8 |
CHCl2 + 0,5H2 |
2560 |
С* + 2HCl |
-258 |
-129 |
9 |
CCl3+1,5H2 |
2330 |
C* + 3HCl |
-357 |
-119 |
| 10 | CH2Cl2 |
1403 |
C* + 2HCl |
-90 |
-45 |
11 |
CH3Cl+ CHCl3 |
1430 |
2C* + 4HCl |
-184 |
-46 |
12 |
CHCl3 + H2 |
1780 |
C* + 3HCl |
-174 |
-58 |
13 |
CCl4 + CH4 |
1500 |
2C* + 4HCl |
-199 |
-50 |
14 |
CCl4 + 2H2 |
1990 |
C* + 4HCl |
-273 |
-68 |
15 |
C2Cl + C2H |
3655 |
4C* + HCl |
-1121 |
-121 |
16 |
C2Cl+0.5H2 |
3410 |
2C* + HCl |
-586 |
-586 |
17 |
C2HCl |
3020 |
2C* + HCl |
-305 |
-305 |
18 |
C2Cl2+C2H2 |
3025 |
4C* + 2HCl |
-611 |
-306 |
19 |
C2Cl2 + H2 |
2820 |
2C* + 2HCl |
-384 |
-192 |
20 |
C2Cl3+C2H3 |
2950 |
4C* + 3HCl |
-727 |
-247 |
21 |
C2Cl3 + 1,5H2 |
2691 |
2C* + 3HCl |
-467 |
-156 |
22 |
C2H2Cl2 |
2000 |
2C* + 2HCl |
-188 |
-94 |
23 |
C2H3Cl+ C2HCl3 |
2035 |
4C* + 4HCl |
-388 |
-97 |
24 |
C2Cl4+C2H4 |
2115 |
4C* + 4HCl |
-410 |
-103 |
25 |
C2HCl3+ H2 |
2125 |
2C* + 3HCl |
-273 |
-91 |
26 |
C2Cl4 + 2H2 |
1885 |
2C* + 4HCl |
-358 |
-90 |
27 |
C2Cl5+C2H5 |
2415 |
4C* + 5HCl |
-607 |
-121 |
28 |
C2Cl5 + 2,5H2 |
2030 |
2C* + 5HCl |
-500 |
-100 |
29 |
C2H3Cl3 |
1360 |
2C* + 3HCl |
-138 |
-46 |
30 |
C2H5Cl+ C2HCl5 |
1425 |
4C* + 6HCl |
-299 |
-50 |
31 |
C2H2Cl4 +C2H4Cl2 |
1340 |
4C* + 6HCl |
-270 |
-45 |
32 |
C2H2Cl4 + H2 |
1450 |
2C* + 4HCl |
-215 |
-54 |
33 |
C2HCl5 + 2H2 |
1850 |
2C* + 5HCl |
-319 |
-64 |
34 |
C2Cl6 + C2H6 |
1530 |
4C* + 6HCl |
-330 |
-55 |
35 |
C2Cl6 + 3H2 |
1980 |
2C* + 6HCl |
-412 |
-69 |
36 |
CCl4 + 2/3C3H6 |
1735 |
3C* + 4HCl |
-451 |
-113 |
37 |
CCl4 + C3H5Cl |
1780 |
4C* + 5HCl |
-365 |
-73 |
38 |
CCl4 + 0,4C4H10 |
1540 |
2,6C* + 4HCl |
-223 |
-56 |
39 |
C4H9Cl + 2CCl4 |
1490 |
6C* + 9HCl |
-477 |
-53 |
40 |
CCl4+1/3C5H12 |
1555 |
8/3C* + 4HCl |
-224 |
-56 |
41 |
C5H11Cl+ 2,5CCl4 |
1510 |
7,5C* + 11HCl |
-600 |
-55 |
42 |
CCl4 + 0,5C3H8 |
1560 |
2,5C* +4HCl |
-221 |
-55 |
43 |
C3H7Сl+1,5CCl4 |
1485 |
4,5C* + 7HCl |
-372 |
-53 |
44 |
C3H6Cl2+ CCl4 |
1400 |
4C* + 6HCl |
-292 |
-49 |
45 |
C3H5Cl3 + 0,5CCl4 |
1335 |
3,5C* + 5HCl |
-228 |
-46 |
46 |
C6Cl6+C6H6 |
1690 |
12C* + 6HCl |
-503 |
-84 |
47 |
C6Cl6+3H2 |
1830 |
6C* + 6HCl |
-519 |
-86 |

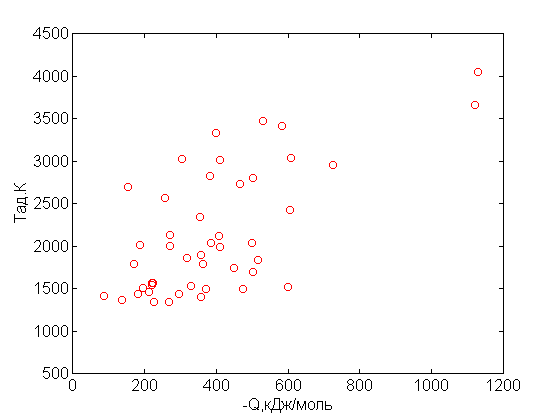
Рис.1. Зависимость адиабатической температуры от теплоты реакции
на один моль исходного вещества.

Рис.2. Адиабатическая температура как функция теплоты реакции к одному молю HCl
Для выбранных химических реакций рассчитан тепловой эффект реакции Q, который согласно следствию закона Гесса равен сумме теплот образования получившихся продуктов за вычетом суммы теплот образования исходных веществ. Значения Тад для различных Q на один моль исходного вещества приведены в табл.1 и на рис.1. Из рисунка видно, что точки расположены хаотично и не могут быть описаны определенной функциональной зависимостью.
Так как основное выделение тепла в рассматриваемых реакциях происходит при образовании хлористого водорода, то тепловой эффект был отнесен к одному молю HCl. Как видно из рис.2, в этом случае точки удовлетворительно укладывается на одну кривую. Полученный график может быть использован на практике для расчета адиабатической температуры по известным значениям теплового эффекта реакции.
Из анализа следует, что благодаря достаточно высокой адиабатической температуре можно ожидать автотермичности процесса переработки хлорорганических веществ при восстановительном пиролизе. При этом для инициирования начала процесса используется плазма (водородная или аргоновая) при малых энергетических затратах на ее генерацию.
Литература
1. Дубовой Л.И., Адитайс Э.Р., Берлин Э.Р., Трегер Ю.А. // Химическая промышленность. 1982. №11. С.18-19.
2. Мазанко А.Ф., Антонов В.Н., Рожков В.И., Заликин А.А. // Химическая промышленность. 1986. №5. С.272-275.
3. Федоров Л.А. Диоксины как экологическая опасность: ретроспектива и перспективы. М.: Наука.1993.- 266с.
4. Мальцева А.С., Фролов Ю.Е., Жарова Н.Н., Розловский А.И. // Химическая промышленность. 1984. №1. С.19-22.
5. Антонов В.Н., Рожков В.И., Заликин А.А. // Журнал прикладной химии. 1987. №6. С.1347-1352.
6. Шмыков Ю.И., Шорин С.Н., Сурис А.Л. // Химия высоких энергий. 1977. Т.11. №4. С.371-375.
7. Сталл Д., Вестрам Э., Зинке Г. Химическая термодинамика органических соединений. М.: Мир, 1971.- 807с.
8. Гурвич Л.В., Вейтс И.В., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. М.: Наука, 1979. Т.2, кн.2.- 344с.
9. Трусов Б.Г. Моделирование химических и фазовых равновесий при высоких температурах (АСТРА-4/рс). М.: МГТУ им. Н.Э. Баумана, 1994.- 50с.
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |