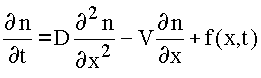 , (1)
, (1) Школа по плазмохимии для молодых ученых России и стран СНГ
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
МЕТОДИКА КИНЕТИЧЕСКИХ ИЗМЕРЕНИЙ В НЕСТАЦИОНАРНОМ РЕЖИМЕ ТРАВЛЕНИЯ ПОЛИМЕРОВ В НЕРАВНОВЕСНОЙ ПЛАЗМЕ
Иванов А.Н., Рыбкин В.В., Кувалдина Е.В., Смирнов С.А., Титов В.А.
Ивановский государственный химико-технологический университет
Плазменная обработка полимеров в настоящее время используется для получения целого ряда полезных технологических эффектов, связанных с изменением поверхностных свойств материалов. Однако знания механизмов реакций, протекающих при модифицировании, еще недостаточны для априорного предсказания результатов плазменного воздействия на материал. Прежде всего это касается стадий инициирования. Эксперименты показывают, что плазмоокислительная деструкция полимеров является многоканальным и многостадийным процессом. Ясно, что если инициирование происходит по нескольким каналам, то кинетические данные, полученные в условиях установившегося во времени процесса, недостаточно информативны. В данной работе предлагается метод определения скоростей образования газообразных продуктов взаимодействия плазмы с полимерами в нестационарном режиме, который имеет место при зажигании разряда или после его выключения; а также некоторые результаты, полученные с его помощью, касающиеся системы плазма О2 — полиимид.
Эксперименты проводились в цилиндрическом реакторе из стекла марки С52 радиусом 1.5 см. Тлеющий разряд постоянного тока возбуждали в потоке кислорода при давлении 50 Па и токе 80 мА. Линейная скорость потока газа составляла 30 см/с. Образцы пленок полиимида марки Kapton-H толщиной 20 мкм размещали в виде кольца радиусом 1.5 см и шириной 2.5 см на термостатируемой стенке реактора в зоне положительного столба. Перед зажиганием разряда образцы обезгаживались при давлении 0.1 Па и температуре 363 К. На расстоянии 1 см от края образца в направлении потока газа в стенке реактора располагалась диафрагма диаметром 20 мкм, через которую газ из реактора поступал в анализатор масс-спектрометра ИПДО-2А, откачиваемый геттерно-ионным насосом НОРД-250. Для определения парциальных давлений измерительная система масс-спектрометра калибровалась по чистым газам О2, СО2, СО, Н2О и Н2.
Процедура измерений заключалась в следующем. Первоначально проводилась серия І холостыхІ опытов. Зажигался разряд в отсутствие образца и регистрировались І фоновыеІ кинетические кривые - зависимости парциальных давлений измеряемых компонентов от времени. Аналогичные измерения делались и при выключении разряда. Затем такая же процедура повторялась, но с образцом в зоне плазмы. Из полученных зависимостей І фоновыеІ значения вычитались.
В условиях эксперимента изменения концентраций частиц связаны не только с протеканием химических реакций, но также обусловлены и явлениями переноса. Уравнение непрерывности плотности потока газообразного продукта реакции, усредненное по сечению реактора, имеет вид:
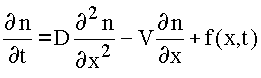 , (1)
, (1)
где x - координата вдоль оси реактора, t - время, n- концентрация , D - коэффициент диффузии, V - линейная скорость потока газа, f(x,t) - плотность источников (сумма скоростей образования и гибели частиц данного компонента).
Решение этого
уравнения для -![]() < x <
< x < ![]() , t > 0 и
нулевого начального условия дается
выражением:
, t > 0 и
нулевого начального условия дается
выражением:
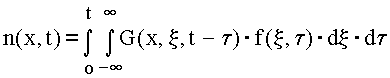 , (2)
, (2)
где ![]() - функция источника.
- функция источника.
Решая однородное
уравнение, соответствующее (1), на
отрезке 0 - L c граничными условиями
n(0) = n(L) = 0 и находя предел решения
при L![]() ,
получим
,
получим
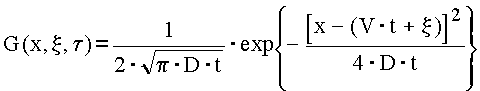 . (3)
. (3)
Обозначая через ![]() среднюю
скорость образования частиц с
единицы поверхности материала, из
(2) и (3), получаем
среднюю
скорость образования частиц с
единицы поверхности материала, из
(2) и (3), получаем
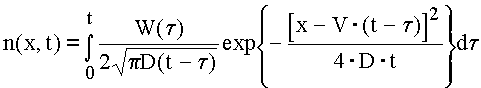 , (4)
, (4)
где х – расстояние от образца до диафрагмы.
При обработке результатов необходимо принять во внимание также то обстоятельство, что система регистрации масс-спектра имеет свое временное разрешение, определямое характеристиками усилителей, транспортными характеристиками системы дифференциальной откачки, диафрагмы и т.д. Связь между измеряемой концентрацией n*(t) и ее значением в реакторе n(t) дается уравнением
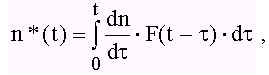 (5)
(5)
где ![]() - передаточная функция
системы регистрации (ее реакция на
единичное ступенчатое изменение
концентрации).
- передаточная функция
системы регистрации (ее реакция на
единичное ступенчатое изменение
концентрации).
Передаточная функция системы находилась следующим образом. При закрытой диафрагме масс-спектрометра в реактор напускалась приготовленная смесь газов до установления постоянного давления. Диафрагма открывалась (время окрытия t Ј 0.1 с) и регистрировалось временное изменение сигнала соответствующей массы. Измерения проводились в интервале полных и парциальных давлений, соответствующих условиям экспериментов. Оказалось, что нормированные на единицу передаточные функции не зависят от давления, хотя их вид различен для разных газов. Минимальное время релаксации наблюдается для водорода, а максимальное - для паров воды.
Уравнения (4)-(5)
есть интегральные уравнения
Вольтерра первого рода. Их
последовательное решение с
экспериментально измеренными
зависимостями n*(x,t) и известными D, V, ![]() позволяет
найти скорости
позволяет
найти скорости ![]() . Поскольку (4)-(5) относятся к
классу некорректных задач, то для
их решения мы использовали
конечно-разностные численные
схемы, основанные на вариационном
методе регуляризации, со
стабилизатором Тихонова 1-го
порядка. Тестирование программы
проводилось на модельных задачах .
. Поскольку (4)-(5) относятся к
классу некорректных задач, то для
их решения мы использовали
конечно-разностные численные
схемы, основанные на вариационном
методе регуляризации, со
стабилизатором Тихонова 1-го
порядка. Тестирование программы
проводилось на модельных задачах .
На рис.1-3 приведены скорости образования основных газообразных продуктов и расходования кислорода, полученные в следующей последовательности опытов. Рис.1 - зажигание разряда с образцом, не подвергавшимся ранее действию плазмы. Длительность обработки этого этапа определялась установлением стационарных скоростей (~ 15 с.). Рис.2 - выключение разряда после первого этапа. Его длительность составляла ~ 10 с. и определялась исчезновением продуктов реакций. Рис.3 - повторное включение разряда без извлечения образца. Достигаемые стационарные скорости для 1-го и 3-го случаев были одними и теми же.
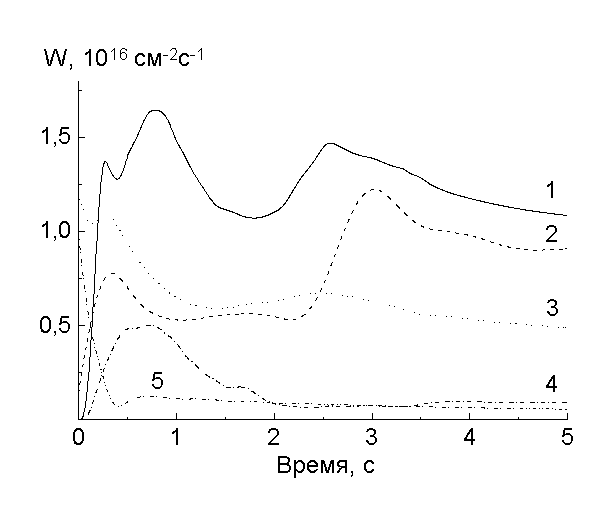
Рис.1. Скорости расходования О2 (1) и выделения продуктов травления: СО2 (2), СО (3), Н2О (4), Н2 (5), - при первом включении разряда
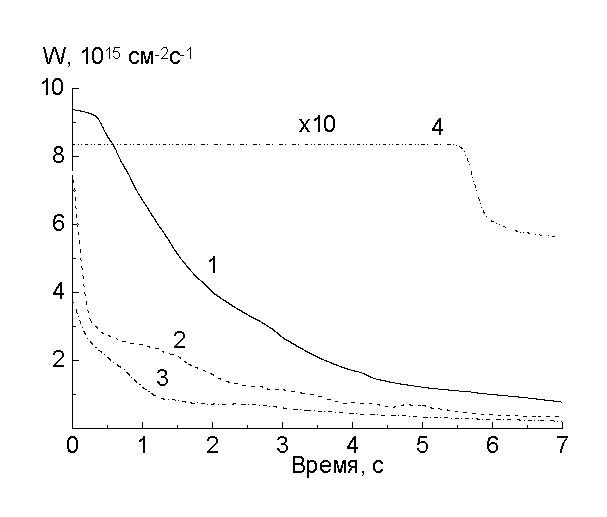
Рис.2. Скорости расходования О2 (1) и выделения продуктов: СО2 (2), СО (3), Н2О (4), - после выключения разряда при первом травлении полиимида
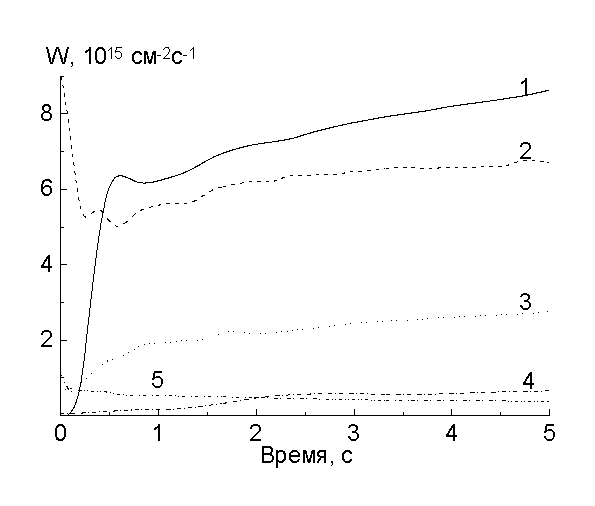
Рис.3. Скорости расходования кислорода (1) и выделения продуктов: СО2 (2), СО (3), Н2О (4), Н2 (5), - при повторном включении разряда
Полученные результаты ясно показывают, что процессы взаимодействия имеют сложный многостадийный и многоканальный характер. Для того, чтобы кислород начал реагировать с полимером, во всех случаях необходима предварительная активация поверхности. Для І свежегоІ образца она связана с образованием водорода и молекул СО, причем в начальные моменты времени их образование происходит без непосредственного химического участия кислорода. Если сравнивать начальные скорости образования газообразных продуктов со стационарными скоростями образования частиц плазмы, то плотности потоков ~ 1Ч 1016 см-2 могут быть обеспечены атомарным кислородом и метастабильными состояниями О2(a1D g, b1S -g) . Но если учесть, что при примерно равных плотностях потоков энергия, выделяющаяся при дезактивации О2(a1D g, b1S -g) (1.63 и 0.98 эВ) меньше , чем при рекомбинации атомов (5.1 эВ), а энергия разрыва связи , например Аr-H, составляет 4.3 эВ, то возможностей метастабильных молекул уже недостаточно. Однако, если бы только энергия, выделяющаяся при рекомбинации, являлась источником инициирования, то не было бы вышеотмеченных различий в кинетике, имеющей место в зоне плазмы и ее послесвечении. По-видимому, имеет место совместное действие всех энергетически возможных факторов.
Водород в элементарном звене ПИ находится только в бензольных кольцах, а СО в виде карбонильных и эфирных групп содержится в имидных циклах и дифениловом фрагменте:
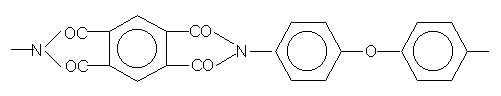
Следовательно, инициирование начинается с распада имидных циклов и отщепления атомов водорода от бензольных колец. Быстрое уменьшение скорости образования СО и Н2 на начальном этапе, по-видимому, связано с уменьшением количества соответствуюших групп, доступных для распада под действием физических факторов, а также с тем, что первичные радикалы НЧ и R-COЧ , начинают реагировать в клетке с кислородом. Возможными продуктами этих реакций могут быть Ч ОН, R-COOЧ , R-COЧ , R-СООН и R-OH. Радикалы НЧ и ОНЧ , выходя из клетки, образуют соответственно Н2 и Н2О по реакциям типа RH+HЧ ® H2+RЧ , RH+Ч OH® RЧ +H2O, а распад гидроперекисей и пероксидных радикалов приводит к выделению Н2О и СО2. Об этом говорит тот факт, что уменьшение скоростей образования СО и Н2 сопровождается возрастанием скоростей расходования кислорода и образования молекул Н2О и СО2 (рис.1). Радикалы, образующиеся в этих реакциях, должны иметь ароматическую природу. По видимому, их накопление (квазистационарный участок от 1 до 2 с на рис.1) и распад приводит к раскрытию бензольных колец. Взаимодействие вновь появившихся радикалов с кислородом приводит к появлению следующего максимума в скорости его расходования (при ~ 2.5 с), с последующим образованием преимущественно молекул СО2 и в меньшей степени — СО. Вероятно, здесь тоже конкурируют процессы образования СО и СО2.
При выключении разряда в течение ~ 0.5 с скорость расходования кислорода меняется мало (рис.2). Характерное время жизни атомов О(3Р) и О2(a1D g, b1S -g) в этих условиях меньше 0.1 с. Следовательно, реагируют молекулы кислорода в основном состоянии. Но это взаимодействие не приводит к образованию летучих продуктов, так как за это время скорости образования СО2 уменьшаются в 3, СО в 1.8 раза, а Н2 изчезает за время <0.1 с. Поэтому можно предполагать, что появление радикалов НЧ с последующим образованием Н2 инициируется физическими факторами, а О2 реагирует по тем активным центрам, которые при горении разряда вступали в реакции с более активными реагентами. По-видимому, продуктами этих реакций являются пероксидные радикалы, распад которых без участия кислорода при повторном зажигании разряда (рис.3) приводит к преимущественному образованию молекул СО2. Эти же данные показывают, что анализ химического состава, проводимый любыми поверхностно-чувствительными методами, в количественном отношении может неоднозначно характеризовать процессы в полимере при действии на него плазмы. Таким образом, молекулярный кислород в основном состоянии, по-видимому, не является основным реагентом, но он определяет пост-эффекты взаимодействия. Более быстрое уменьшение скорости образования СО2, чем СО при выключении разряда показывает, что они образуются в конкурирующих процессах. Картина, связанная с конкуренцией процессов, наблюдается и для стационарных скоростей: при постоянном токе разряда с ростом давления или при постоянном давлении с ростом тока разряда выходы молекул СО и Н2О в пересчете на одну реагирующую молекулу О2 уменьшаются. Это позволяет предполагать, что кислород, реагирующий в клетке и уменьшающий выход радикалов из нее, вступает в реакцию преимущественно в виде атомов, а конкурирующими реакциями могут быть реакции типа RCOЧ ® RЧ +CO, RCOЧ +O ® RCOOЧ ® CO2+ RЧ .
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |