Школа по плазмохимии для молодых ученых России и стран СНГ
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
ПРОЦЕССЫ ОБРАЗОВАНИЯ И ГИБЕЛИ АТОМОВ ХЛОРА В ПЛАЗМЕ СМЕСИ ХЛОРА С ВОДОРОДОМ
Ю. В. Кириллов, Д. В. Ситанов, В. И. Светцов.
Ивановский государственный химико-технологический университет
153460, Иваново-центр, пр. Ф. Энгельса, 7
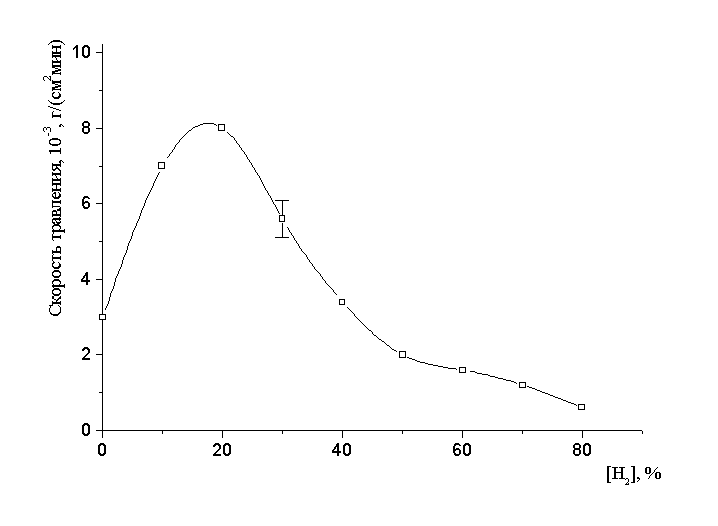
В настоящее время процессы плазмохимического травления в неравновесной низкотемпературной плазме находят широкое применение в технологии производства полупроводниковых приборов, интегральных микросхем, а также для формирования рисунка печатных плат. Традиционно для травления кремния, в качестве плазмообразующей среды использовались фторсодержащие газы [1]. Вовлечение в технологию производства новых материалов, таких как арсенид галлия, медь, алюминий показало, что скорость их травления во фторе очень мала ввиду образования на их поверхности продуктов травления обладающих малой летучестью. В настоящее время для их травления успешно используется плазма хлора [2]. Кроме того, применение хлора позволяет получить более высокую анизотропию при травлении кремниевых структур. С другой стороны, было замечено, что при разбавлении хлора водородом скорость травления ряда неорганических материалов не только не уменьшается, но и в некоторых случаях возрастает. На рис.1 приведена экспериментальная зависимость скорости травления арсенида галлия от доли водорода в смеси плазмообразующего газа. Видно что максимальная скорость травления достигается при 20%-ом разбавлении хлора водородом. Этот эффект представляет большой технологический интерес, так как позволяет снизить расход газа-реагента без существенного уменьшения скорости травления, а также продлить срок службы откачных систем, уменьшить выброс токсичных веществ в атмосферу. Однако, применение смесей хлора с водородом в технологии плазмохимического травления сдерживается недостатком сведений о кинетике и механизмах протекающих реакций, данных по коэффициентам скоростей (вероятностям взаимодействия), позволяющих прогнозировать характер, направление и скорость процесса. Поэтому, учитывая, что в хлорной плазме основными травящими частицами являются атомы хлора [3], исследование кинетики, механизмов образования и гибели атомов в плазме Cl2 и его смеси с водородом представляет интерес.
Концентрация атомов хлора в разряде определяется процессами их образования и гибели. Образование атомов в плазме может происходить в результате:
Прямой диссоциации молекул хлора при электронном ударе:
Cl2 + e ® Cl + Cl + e, (1)
Диссоциативного прилипания электронов к молекулам Cl2:
Cl2 + e ® Cl2- ® Cl + Cl-, (2)
А также в процессе ион-ионной рекомбинации:
Cl2+ + Cl- ® 3Cl (3)
Гибель атомов хлора происходит в основном в результате процесса гетерогенной рекомбинации на стенке реактора:
Cl ® 1/2Cl2 (4)
С целью получения данных по скоростям элементарных процессов в плазме с участием электронов был проведен расчет ФРЭЭ и коэффициентов скоростей этих процессов путем численного решения уравнения Больцмана. При этом использовались экспериментальные данные по концентрациям молекул хлора в разряде [Cl2], температуре газа (Tг) приведенной напряженности электрического поля (E/N0), подвижностям ионов (Bi), приведенные в таблице 1. Измерения проводились в стеклянном реакторе проточного типа с внутренним диаметром 1.8 см., в котором возбуждался электрический разряд постоянного тока, с плотностью тока 4.5.10-3 А/см2. Общее давление газовой смеси поддерживалось постоянным, равным 100 Па. Концентрация молекул Cl2 определялась по поглощению ультрафиолетового излучения с использованием метода абсорбционной спектроскопии. Метод адсорбционной спектроскопии успешно применялся для непосредственного определения концентрации молекул хлора в разряде [4].
Исходная концентрация частиц в плазме N0 определялась по уравнению состояния идеального газа. Концентрация атомов хлора рассчитывалась для каждого конкретного случая по формуле: [Cl] = 2a .N0
где a - степень диссоциации молекул хлора, также приведенная в таблице 1 и полученная по методике работы [5].
Температура плазмы измерялась методом двух термопар [6]. Приведенная напряженность поля E/N измерялась методом компенсации тока в цепи электростатических зондов, помещаемых в зону положительного столба тлеющего разряда.
На рис. 2 показан ход экспериментальной зависимости концентрации атомов хлора в разряде (кривая 1). Если считать водород пассивным разбавителем, то при увеличении доли водорода концентрация атомов хлора должна линейно уменьшаться (пунктир на рис. 2). Однако мы наблюдаем некоторое увеличение концентрации атомов хлора, соответствующее содержанию водорода 10%, а затем более медленный спад, чем при линейной зависимости. Рассмотрим вероятные причины такого явления. Их можно разделить на две группы. Первая, связана с изменением электрофизических параметров плазмы, то есть концентрации электронов в разряде и как следствие этого скоростей процессов с их участием, приводящих к диссоциации молекул хлора (механизм 1 и 2). Вторая, связана с дополнительной диссоциацией молекул хлора при его взаимодействии с водородом в метастабильном состоянии a 3S g+, c3p u.
Увеличение концентрации атомов хлора в разряде может быть связано также с уменьшением их гибели на стенке разрядной трубки (механизм 4). Однако в данной работе изменением вероятности гетерогенной гибели атомов хлора пренебрегали и считали, что гибель атомов хлора на стенке реактора неизменна и оценивается коэффициентом гетерогенной гибели 2.7 с-1 для всех процентных содержаний водорода в смеси.
Следует также отметить возможность вклада механизма ион-ионной рекомбинации, дающей выход в объем реактора трех атомов хлора (механизм 3). В данной работе вклад этого механизма оценивался с коэффициентом 5? 10-8 см3/с. Коэффициент скорости и сами скорости указанных процессов приведены в таблице 2. В работе [7] отмечается, что процессы диссоциативного прилипания являются беспороговыми. Поэтому, можно предположить, что механизм (2) является основным при образовании атомов, тем более что порог прямой диссоциации молекул хлора при электронном ударе составляет 2.5 эВ. [8] Однако, по нашим данным, скорость процесса диссоциативного прилипания для всех процентных содержаний водорода в смеси оказалась в среднем на порядок величины меньше скорости процесса прямой диссоциации молекул Cl2. Из таблицы 2 видно, что наибольшая скорость из всех рассмотренных процессов образования атомов хлора (1, 2 и 3), соответствует процессу диссоциации молекул хлора при прямом электронном ударе. Процессы 2 и 3 вносят малый вклад. Так, диссоциативное прилипание и ион-ионная рекомбинация вносят приблизительно по 4% в общую диссоциацию молекул хлора по сравнению с каналом диссоциации Cl2 при прямом электронном ударе. Таким образом, основным механизмом образования атомов хлора можно считать диссоциацию при прямом электронном ударе, а остальными процессами пренебречь ввиду их малой скорости.
Скорость процесса прямой диссоциации зависит от концентрации электронов, которая определяется электрофизическими параметрами плазмы. Известны ряд работ, в которых отмечается, что при разбавлении сильно электроотрицательного газа электроположительным может существенным образом меняться механизм диффузии электронов на стенку разрядной трубки. Данный процесс приводит к снижению вероятности гетерогенной гибели электронов на стенке разрядной трубки и увеличению их концентрации в объеме [9]. При этом должно наблюдаться некоторое снижение темпа спада скоростей процессов с участием электронов при разбавлении хлора водородом по сравнению с ожидаемым, когда уменьшение скорости процесса определяется только снижением концентрации молекул хлора в разряде. На рис. 3 приведена расчетная зависимость концентрации электронов в плазме от доли водорода. Видно что при изменении концентрации водорода от 0 до 50 % концентрация электронов в плазме остается практически постоянной и следовательно, не может сказываться на изменении скорости диссоциации молекул хлора с участием электронов. Однако, при больших процентных содержаниях водорода в смеси плазмообразующего газа учет канала изменения электрофизических параметров плазмы может полностью объяснить характер поведения концентрации атомов хлора в разряде при содержании водорода в плазме от 60 до 90%.
На рис. 2 зависимость 2 отражает ход расчетной концентрации атомов хлора, полученной в предположении о постоянстве коэффициента гетерогенной гибели атомов хлора, с учетом вклада механизма изменения электрофизических параметров плазмы. Сравнивая эту зависимость с ходом экспериментальной концентрации атомов хлора (зависимость 1 рис. 2) видно, что в диапазоне концентрации водорода от 0 до 70 % данный механизм не обеспечивает наблюдаемой концентрации атомов, но в диапазоне концентрации водорода от 70 до 90 % расчетная зависимость хорошо описывает экспериментальную. Данный факт хорошо согласуется с ходом концентрации электронов в разряде, которая на уровне 70-75%-го содержания водорода в смеси имеет максимум.
Оценка диссоциации молекул хлора при взаимодействии с метастабильными молекулами водорода проводилась в предположении что метастабили водорода образуются при электронном ударе (коэффициент скорости и скорость этого процесса приведены в таблице 2), а гибнут при диссоциативном возбуждении молекул хлора. Если считать что все образующиеся метастабили идут на образование атомов хлора (оценка сверху), то вклад этого процесса становится ощутим уже при 80%ом содержании водорода. Однако, с учетом стеночной и объемной гибели метастабилий этот механизм не может превышать 5-10% по сравнению с суммарным механизмом диссоциации молекул хлора с участием электронов.
Таким образом, рассмотренные нами процессы не могут полностью объяснить наблюдаемый экспериментально ход концентрации атомов хлора в разряде при разбавлении плазмообразующей смеси водородом.
Однако известно, [10] что в плазме хлор-водород протекают цепные реакции типа:
Cl2 + H ® HCl + Cl (6)
Cl + H2 ® HCl + H (7)
Эти процессы, которые можно рассматривать как канал образования и как канал гибели атомов хлора, пока не могут быть нами учтены. Вклад этих процессов может обеспечить дополнительный выход атомов хлора в объеме реактора и таким образом объяснить отличие экспериментальной и расчетной концентрации атомов хлора в разряде.

Рис. 1 Зависимость скорости травления арсенида галлия от состава плазмообразующей смеси (P=100 Па, Iр=20 мА, Tг=353 K).
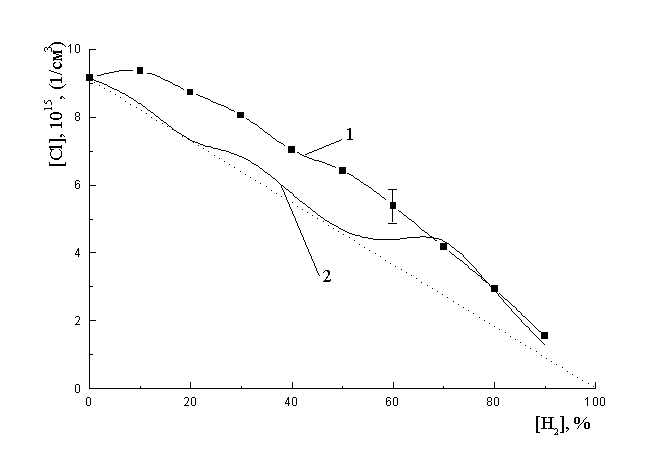
Рис. 2 Концентрации атомов хлора в разряде: 1- экспериментальная, 2- расчетная, с учетом изменения электрофизических параметров плазмы.
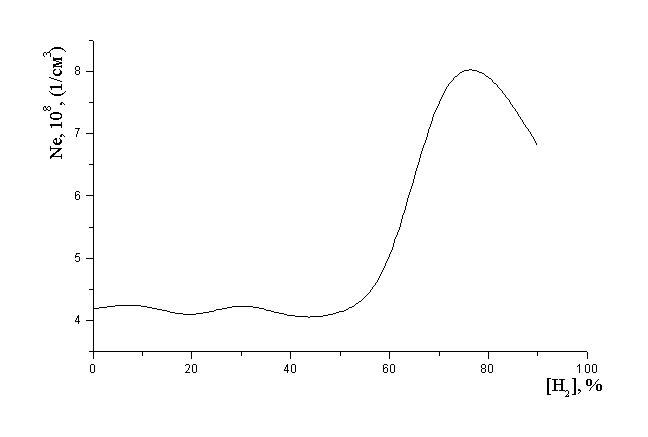
Рис. 3 Расчетная зависимость концентрации электронов в разряде от состава плазмообразующего газа.
Таблица 1.
[H2], % |
[Cl2],1015 см-1 |
a |
Tг, K |
E/N0, 10-15 В/см2с |
Bi, м2/В.с |
0 |
10,7 |
0,3 |
474 |
2,44 |
0,407 |
10 |
9,07 |
0,34 |
474 |
2,45 |
0,410 |
20 |
7,76 |
0,36 |
478 |
2,50 |
0,424 |
30 |
6,86 |
0,37 |
466 |
2,46 |
0,413 |
40 |
5,73 |
0,38 |
470 |
2,51 |
0,427 |
50 |
4,43 |
0,42 |
474 |
2,49 |
0,421 |
60 |
3,42 |
0,44 |
474 |
2,23 |
0,349 |
70 |
2,45 |
0,46 |
478 |
1,67 |
0,210 |
80 |
1,59 |
0,48 |
474 |
1,42 |
0,154 |
90 |
0,8 |
0,49 |
462 |
1,30 |
0,129 |
Таблица 2.
Коэффициент скорости и скорость процесса |
|||||||||
[H2], % |
Ион-ионная рекомбинация |
Диссоциативное прилипание |
Прямая диссоциация |
Образование метастабилий |
|||||
К, 10-8 |
Г, 1014 |
К, 10-10 |
Г, 1014 |
К, 10-9 |
Г, 1016 |
К, 10-11 |
Г, 1013 |
||
см3/с |
см-3с-1 |
см3/с |
см-3с-1 |
см3/с |
см-3с-1 |
см3/с |
см-3с-1 |
||
0 |
5,00 |
9,38 |
2,10 |
9,38 |
5,54 |
2,48 |
4,27 |
0 |
|
10 |
5,00 |
8,08 |
2,10 |
8,08 |
5,90 |
2,27 |
5,29 |
3,42 |
|
20 |
5,00 |
6,68 |
2,10 |
6,68 |
6,22 |
1,98 |
6,54 |
8,12 |
|
30 |
5,00 |
6,07 |
2,09 |
6,07 |
6,36 |
1,85 |
7,36 |
14,5 |
|
40 |
5,00 |
4,85 |
2,07 |
4,85 |
6,62 |
1,55 |
9,11 |
22,9 |
|
50 |
5,00 |
3,75 |
2,04 |
3,75 |
6,89 |
1,26 |
11,2 |
35,4 |
|
60 |
5,00 |
3,51 |
2,03 |
3,51 |
6,87 |
1,19 |
11,3 |
52,3 |
|
70 |
5,00 |
3,76 |
2,04 |
3,76 |
6,37 |
1,17 |
8,24 |
65,5 |
|
80 |
5,00 |
2,52 |
2,01 |
2,52 |
6,21 |
0,779 |
8,20 |
79,1 |
|
90 |
5,00 |
1,07 |
1,96 |
1,07 |
6,35 |
0,346 |
10,8 |
104,0 |
|
Примечание. К- коэффициент скорости, Г- скорость соответствующего процесса.
Список литературы.
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |