
Школа по плазмохимии для молодых ученых России и стран СНГ
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
ФИЗИКА И ХИМИЯ ВЗАИМОДЕЙСТВИЯ ПЛАЗМЫ С РАСТВОРАМИ.
А.И. Максимов.
Институт химии растворов РАН
1.Введение.
Первые сведения о разных видах газового разряда, контактирующего с органическими жидкостями и растворами электролитов относятся к концу 19-ого века. Систематические исследования взаимодействия газового разряда с растворами электролитов были начаты в десятых годах 20-ого века в работах А. Клеменка. В пятидесятых годах они были продолжены А. Хиклингом с сотрудниками. Первоначально это направление рассматривалось как раздел классической электрохимии, дополненный гипотезой о вкладе в инициирование химических реакций излучения разряда, а позже - радиационно-химических эффектов, вызываемых бомбардировкой поверхности раствора генерируемыми в плазме ионами.
Взаимодействие газового разряда с растворами может быть организовано несколькими существенно различающимися способами.
1. Импульсный пробой жидкой фазы.
2. Контактирующий с жидкостью разряд между расположенными в газовой фазе электродами.
3. Стационарный или квазистационарный разряд, в котором роль одного или обоих электродов выполняет раствор электролита.
В первом случае после пробоя возникает канал плазмы в парах обрабатываемой жидкости, в котором генерация химически активных частиц происходит в газовой фазе под действием электронов, ускоряемых полями, характерными для импульсных разрядов. Во втором случае ситуация близка к обычной для плазмохимии, когда генерируемые в плазме активные частицы диффундируют к границе раздела фаз и инициируют химические превращения в растворе. В третьем, наиболее характерном случае, ток разряда проходит через электролит, что существенно меняет свойства границы раздела фаз плазма - жидкость. При этом плазма может создаваться в исходном плазмообразующем газе, содержащем пары растворителя или в паровой оболочке, возникающей внутри жидкой фазы вследствие перегревной неустойчивости. Возможные конфигурации системы, различающиеся ролью металлических и электролитных электродов, показаны на рис.1.
Прохождение тока разряда через электролит приводит к возникновению на границах раздела плазма - раствор скачков потенциала, аналогичных хорошо известным катодному и анодному падению напряжения. Следствием этого является перенос через границу раздела фаз из раствора в плазму нейтральных и заряженных частиц (эмиссия заряженных частиц и “катодное распыление”). Действие разряда на растворы электролитов сопровождается диссоциацией молекул растворителя. Химические взаимодействия образующихся активных частиц ведут к изменению свойств раствора в целом.
2.Физико-химические свойства системы плазма-раствор.
2.1. Тлеющий разряд с жидкостными электролитными электродами (рис.1а). На зажигание разряда между металлическим и электролитным электродами оказывает влияние действие на электролит сил электрического поля, поверхностного натяжения и гравитации. Действие поля, наиболее сильное в случае слабопроводящей дистиллированной воды, приводит к возникновению выпуклого локального профиля поверхности. Это изменяет реальную величину межэлекродного зазора и распределение поля в нем и потому влияет как на условие пробоя, так и на горение стационарного разряда. В воздухе при атмосферном давлении напряжение пробоя между металлом и электролитом существенно ниже, чем между двумя металлическими электродами.


Рис. 1. Способы организации системы плазма - раствор. а - тлеющий разряд, б - диафрагменный разряд, в - контактный разряд, д - разряд между двумя жидкостными электродами.
1 - раствор, 2 - зона плазмы, 3,4 - электроды, 5 - диафрагма, 6 - внутренний сосуд.
Измерения катодного падения потенциала в тлеющем разряде с электролитным катодом дают значения от 200 - 400 В при больших токах и до 700-800 В при малых токах. Это превышает обычные значения нормального катодного падения потенциала в тлеющем разряде пониженного давления. По некоторым данным при изменении тока разряда плотность тока в катодном пятне сохраняется, как в случае нормального тлеющего разряда с металлическими электродами. Механизм эмиссии электронов из электролитного катода не исследован, хотя разумно предполагать его близость к g - эмиссии металлических катодов классического тлеющего разряда, в которой основную роль играет ионнная бомбардировка поверхности. Величина анодного падения может достигать 200 В, что значительно больше соответствующих значений для тлеющего разряда с металлическими электродами. Напряженность поля в положительном столбе тлеющего разряда с жидкими электролитными электродами при атмосферном давлении составляет от 1000 до 1500 В/см. Оценки приведенной напряженности поля показывают, что ее зависимость от параметра pd (произведение давления газа на характерный размер зоны плазмы) согласуется с соответствующими данными для тлеющего разряда с металлическими электродами.
В спектре излучения плазмы разряда с жидкостными электродами при всех условиях наблюдаются линии атомов водорода серии Бальмера, полосы радикалов ОН’, молекулярного азота и NO (при использовании воздуха в качестве исходного плазмообразующего газа). При использовании растворов солей в спектре излучения появляются линии атомов соответствующих металлов. Плазма разряда неоднородна в осевом направлении. Компонентный состав плазмы у катода и анода сильно различен.
Физические свойства границы плазма-раствор и характер активации химических процессов в растворе в сильной степени зависят от полярности электрода, расположенного в гаазавой фазе. В случае электролитного катода падение потенциала у поверхности раствора выше и более эффективно протекают окислительные процессы.
2.2. Контактный тлеющий разряд и диафрагменный разряд.
Рост тока в электролитической ячейке, изображенной на рис.1б, приводит к возникновению перегревной неустойчивости вблизи электрода малого радиуса кривизны или в отверстии диафрагмы и образованию парогазовой зоны. Напряжение источника оказывается приложенным к этой зоне. Происходит пробой и возникает пульсирующий разряд. Физические свойства таких разрядов изучены в очень малой степени. Химическая активация растворов электролитов под действием контактного тлеющего разряда будет рассмотрена ниже.
2.3. Химические процессы, инициируемые плазмой в растворе.
2.3.1. Природа активационных процессов в плазменно-растворной системе.
Если разряд не замыкается на проводящий раствор, его активирующее действие может быть вызвано лишь теми из генерируемых в плазме активных частиц, которые могут достичь поверхности раствора и перейти в него (озон, метастабильные молекулы). При замыкании разряда на раствор инжекция зарядов из плазмы существенно влияет на его свойства.
1. Бомбардировка поверхности раствора ионами, ускоренными в области приповерхностного скачка потенциала, вызывает образование химически активных частиц по механизму, сходному с радиационно-химическим. В случае водных растворов основными первичными активными частицами являются радикалы Н’, ОН’ и сольватированные электроны.
2. Ионы, инжектируемые из зоны плазмы, после быстрой термализации могут рекомбинировать с ионами растворителя, приводя к образованию радикалов. Возможность этого процесса определяется энергетической эффективностью сольватации инжектированных ионов.
2.3.2 Выход первичных активных частиц при плазменной обработке растворов.
Выход сольватированных электронов и радикалов ОН’ при дейстии тлеющего разряда на воду и водные растворы был найден равным 3.3 моль/Фарадей и (6.5 - 9.4) моль/Фарадей, соответственно.
2.3.3.Генерация пероксида водорода.
Пероксид водорода H2O2 является основным устойчивым окислителем, генерируемым в водных и смешанных растворах электролитов под действием плазмы разных типов разряда как при атмосферном, так и при пониженном давлении. Пероксид водорода образуется в результате димеризации радикалов ОН’ в количестве пропорциональном прошедшему количеству электричества. При его накоплении в растворе протекают реакции разложения, что приводит в конце концов к установлению стационарной концентрации H2O2. В первом приближении количество пероксида, образованного в растворе при прохождении данного количества электричества может быть описано описано следующим выражением
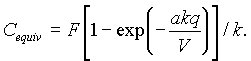 (1)
(1)
Здесь F - постоянная Фарадея, q- количество электричества в Фарадеях, V - объем раствора, k- коэффициент скорости реакции разложения пероксида водорода, а - численный коэффициент,равный 1.1-1.9 и выражающий число г-эквивалентов пероксида, первоначально образующихся на каждый Фарадей прошедшего электричества (начальный выход G0).
Исследования генерации и распада пероксида водорода в растворах 0.05M H2SO4, Na2HPO4, NaOH с разными начальными концентрациями пероксида показало, что в серной кислоте и фосфате натрия количество пероксида под действием разряда изменяется до тех пор, пока не достигаются стационарные значения, соответствующие найденным в экспериментах по синтезу пероксида. В щелочи идет непрерывное разложение пероксида с единичным выходом по току.
На генерацию Н2О2 не оказывают влияния площадь поверхности электролита, длина разрядного промежутка, материал и форма анода. Рост температуры раствора от 20 до 40 0С немного увеличивает выход пероксида. Добавки 0.01М MnSO4, CuSO4, FeSO4, CoSO4 к 0.05 М раствору K2SO4 ведут к слабому падению выхода Н2О2. При воздействии тлеющего разряда на раствор серной кислоты начальный выход пероксида составляет около 1.5 моль/Фарадей. Увеличение давления в пределах 25-200 тор приводит к небольшому его росту. С возрастанием концентрации серной кислоты (0.1 - 2 моль/л) величина G обнаруживает пологий максимум. Добавки HСl к растворам (H2SO4, K2SO4) приводят к падению выхода пероксида до концентраций HСl около 0.01 моль/л. При более высоких концентрациях HCl выход пероксида возрастает.
При действии тлеющего разряда на раствор LiClO4 в метаноле (0.3 М) основным продуктом является формальдегид. Образования пероксида водорода не наблюдалось совсем. Совершенно иная картина наблюдается при плазменной обработке раствора этанола в присутствии кислорода. Действие анодного тлеющего разряда на этанол в нейтральном водном растворе (фосфатный буфер) приводит к образованию ацетальдегида, бутан-2,3-диола и пероксида водорода. Выход этих продуктов в очень сильной степени зависит от наличия и потока кислорода, а также существенно зависит от перемешивания.
2.3.4. Окислительно-восстановительные процессы, инициируемые газовым разрядом в водных растворах неорганических соединений.
В зависимости от условий проведения процесса и состава электролита действие газоразрядной плазмы может приводить как к окислению, так и к восстановлению компонентов раствора. В обоих случаях наблюдается превышение выходов процесса над фарадеевским. Эффект сильнее в окислительных процессах при расположении анода в газовой фазе.
Процессы восстановления.
Перенос катода из раствора электролита в газовую фазу приводит к тому, что катодное восстановление (катодное осаждение) металлов должно происходить на границе раздела фаз раствор - плазма, в зоне анодного пятна. Исследования показали,что металлы, как правило, осаждаются не в чистом виде, а в виде оксидов. Исследовалось также восстановление таких соединений, как FeCl3 , HClO3, HBrO3, HClO4, H2CrO4, HNO3. Восстановление хлората калия KClO3 в нейтральном растворе идет до хлорид-ионов. Восстановление KBrO3 идет очень эффективно уже в нейтральном растворе. Хромовая кислота H2CrO4 почти полностью восстанавливается до соли хрома. Степень восстановления хлорной кислоты HClO4 зависит от концентрации.
Процессы окисления.
Окисление неорганических ионов в водных растворах
Исследования
окисления ![]() в
условиях, приведенных в табл.8 (анод
в газовой фазе), показали, что выход
продуктов окисления (G,
эквивалент/фарадей) может быть
описан следующим соотношением
в
условиях, приведенных в табл.8 (анод
в газовой фазе), показали, что выход
продуктов окисления (G,
эквивалент/фарадей) может быть
описан следующим соотношением
 . (2)
. (2)
Здесь n - число г - эквивалентов окисляющего агента, образующихся в расчете на один фарадей, А и В - эмпирические константы.
Добавка инертных солей (сульфаты калия, натрия, аммония, магния, цинка, алюминия), повышает выход окисления, насыщение раствора молекулярным кислородом не оказывает влияния на процесс.
Исследования окисления сульфатов двухвалентного железа и трехвалентного церия, а также - азида натрия показали, что с ростом концентрации субстрата выход окисления растет, стремясь к насыщению, а выход пероксида падает. С ростом давления выход продуктов окисления имеет тенденцию к падению. Вклад ионов, бомбардирующих раствор, в процесс окисления составляет около 90 %.
Окисление ферроцианида калия K4Fe(CN)6 под действием тлеющего разряда приводит к образованию феррицианида K3Fe(CN)6. Изменение давления воздуха от 30 до 70 торр не влияет на выход феррицианида. В качестве основных реакций окисления предполагаются следующие

Главными продуктами окисления ионов аммония (водный раствор аммиака, тлеющий разряд, ток 15 мА) являются в положительном разряде (анод в газовой фазе) пероксид водорода, гидразин, гидроксиламин, нитрит - ион. В отрицательном разряде не образовывались ни пероксид водорода, ни гидразин. Нитрат -ионы не наблюдались ни при каких условиях. В обоих случаях газообразные продукты - азот и водород. Увеличение двления от 100 торр до 750 торр приводит к уменьшению выхода гидразина приблизительно втрое. Выход гидроксиламина при этом уменьшается на порядок величины, а выход пероксида водорода незначительно возрастает.
Продуктами окисления серной кислоты под действием тлеющего разряда являются Н2О2, пероксидисерная кислота H2S2O8 и пероксимоносерная кислота H2SO5. Рост давления приводит к медленному увеличению начального выхода пероксида водорода (в пределах 1.5-2 моль/F) и падению выхода пероксимоносерной кислоты. Последний при давлении 200 торр приближается к нулю. С ростом концентрации серной кислоты выход пероксимоносерной кислоты практически линейно возрастает, а выход пероксида водорода обнаруживает пологий максимум при концентрации серной кислоты около 1 моль/л.
При действие
тлеющего разряда на кислые и
нейтральные растворы KI в атмосфере
водорода основным продуктом
окисления является молекулярный
иод, кот орый в водных растворах,
содержащих иодид-ионы ![]() , бысро образует
полииодид-ионы
, бысро образует
полииодид-ионы ![]()
Окисление органических соединений.
При действии тлеющего разряда на метанол (40 мл 0.3 М раствора LiClO4 в метаноле, ток разряда 15 мА при давлениях 600, 300 и 100 торр) основными продуктами катодного разряда являлись формальдегид и формиат - ион. В анодном разряде образуется формальдегид и, в количестве около 1% от этого продукта - муравьиная кислота, этиленгликоль и диметоксиметан. Образования пероксида водорода не наблюдалось. И в катодном, и в анодном разрядах основные газообразные продукты - водород, метан и оксид углерода. В следах наблюдались этан, этилен и ацетилен.
При действии тлеющего разряда в кислороде и аргоне на раствор этилового спирта в качестве основных продуктов наблюдались ацетальдегид, пероксид водорода и бутан-2,3-диол. Их выходы в сильной степени зависят от наличия в системе кислорода и от его потока. Другими существенными факторами являются давление газа, эффективность перемешивания, ток разряда и прошедшее количество электричества. При отсутствии кислорода и достаточной концентрации этанола основная начальная реакция - захват радикалов гидроксила молекулами этанола. Реакции атомарного водорода и сольватированных электронов более медленные. Радикал ОН’ отрывает от молекулы этанола водород с образованием следующих продуктов - CH3CH2O’ - 2.5%, CH3CHOH’ - 84/3% , CH2CH2OH’ - 13.2 %. Скорость взаимодействия атомарного водорода с молекулами этанола меньше примерно на два порядка величины. При этом основным процессом является отрыв водорода от группы CH2’ с образованием молекулярного водорода и радикала CH3CHOH’. Радикалы CH3CH2O’ и CH2CH2OH’, в свою очередь, отрывают водород от молекулы этанола, причем во втором случае это ведет к конверсии радикала ОН’ в 1-гидроксиэтильный радикал.
Продукты действия тлеющего разряда на водно-спиртовой раствор в нейтральном фосфатном буфере в атмосфере аргона - пероксид водорода, бутандиол и ацетальдегид.

В присутствии кислорода выходы H2O2 и ацетальдегида растут с концентрацией этанола, что объясняется следующими процессами.

Таким образом, наличие в системе кислорода дает два дополнительных канала образования пероксида водорода. Один из них связан с промежуточным образованием органического перекисного радикала, второй включает радикал пероксил как промежуточный продукт.
Действие коронного разряда на водные растворы красителей приводит к их окислению. Результат сильно зависит от наличия перемешивания и расстояния от электрода до поверхности раствора. Хлорид ионы ингибируют процесс. Предполагается, что активными частицами, инициирующими процесс, являются озон, атомарный кислород, радикалы ОН’ и гидроксил ионы. После обработки раствор совершенно не поглощает свет в области 200 - 900 nm.
К окислительным процессам приводит действие тлеющего разряда на водные растворы красителей. Однако, в этом случае основные окислительные агенты - радикалы ОН’ и пероксид водорода. Совместное действие коронного и тлеющего разрядов приводит к существенному ускорению процесса.
Процессы газовыделения.
При “классическом” электролизе водных растворов электролитов выделение основных газообразных продуктов кислорода и водорода связано с электродными процессами разрядки ионов гидроксила и гидроксония. Если в качестве таких электродов выступает контактирующая с раствором плазма, ситуация меняется. Наблюдается выделение гремучего газа, не описывамое законом Фарадея. Отсутствие выделения газа в районе катодного пятна на поверхности раствора позволяет считать маловероятной объемную рекомбинацию инжектированных в зону плазмы и термализованных ионов. Опыт показывет, что образование гремучего газа происходит преимущественно гетерогенно. Выходы по току кислорода и водорода, наблюдавшиеся в тлеющем и контактном разрядах при всех условиях значительно превышают единицу. Процесс инициируется ионной бомбардировкой раствора. Его механизм в настоящее время не исследован.
Синтез органических соединений, инициируемый газовым разрядом в растворах электролитов.
Образование аспарагина наблюдалось при действии тлеющего разряда на раствор простых аминокислот. Действие тлеющего разряда между расположенным в воздухе металлическим анодом и водным раствором акриламида инициирует полимеризацию.. Исследована зависимость выхода полимера и его средней молекулярной массы от прошедшего количества электричества, концентрации акриламида и давления воздуха. Выход полимера практически линейно растет с увеличением прошедшего количества электричества, достигая 15 моль/Фарадей. Выход полимера и его средняя молекулярная масса линейно возрастают с ростом концентрации акриламида. Увеличение давления воздуха приводит к падению этих характеристик процесса. Эффективность процесса падает в щелочной среде.
3. Плазменное инициирование технологических процессов в водных растворах.
Плазменное воздействие на растворы позволяет инициировать как гомогенные, так и гетерогенные процессы, представляющие практический интерес.
3.1. Возможности использования плазменного активирования процессов обработки целлюлозо- содержащих материалов.
Переработка целлюлозо-содержащих материалов в целлюлозно-бумажной промышленности древесины требует решения двух основных проблем - измельчение материала и его делигнификация. Существующие механические методы измельчения древесины требуют больших энергозатрат и используют громоздкое оборудование. Химические методы делигнификации древесины не удовлетворяют современным требованиям к экологической чистоте производства.
Действие на целлюлозу импульсных и стационарных разрядов в водных и неводных средах позволяет реализовать процессы как измельчения древесины, так и делигнификации. При этом действие импульсных разрядов приводит одновременно к механическим и механо-химическим эффектам. Действие электрогидравлического удара приводит к измельчению материала, лигноуглеводный комплекс подвергается деструкции. Твердый остаток освобождается от азотсодержащих соединений (белков и продуктов их превращений) и соединений кремния, входящих в состав золы. В результате улучшаются физико-механические свойства материала, ликвидируется “одеревенелость”, появляется белизна. Это очень важно в производстве бумаги, а также мелкокристаллической целлюлозы, широко используемой в фармакологии, пищевой и других промышленности
Плазменно-растворная обработка таких дешевых целлюлозосодержащих материалов, как древесные опилки, позволяет в десятки раз увеличить их сорбционные свойства по отношению к ионам тяжелых металлов и органическим соединениям типа фенола. Все это делает перспективным их использование в процессах очистки сточных вод различных производств.
К числу гетерогенных процессов, инициирумых плазменным воздействием на растворы, относятся модифицирование свойств поверхностей полимерных материалов, включая ткани из натуральных и синтетических волокон (процессы подготовки тканей перед печатанием, крашением и т.д.), отбеливание тканей, и т.д.
3.2. Использование плазменно-растворных систем для очистки воды.
Большое количество исследований посвящено проблеме очистки и обеззараживания воды с помощью различных типов газовых разрядов. Предполагается, что обеззараживающее действие импульсного электрического разряда в воде связано с несколькими факторами влияния на микроорганизмы. Под действием свободных атомов и радикалов происходит распад аминокислот и белка, деполяризация нуклеиновых кислот, расщепление других биологически активных веществ. Кроме этого, непосредственное действие на микроорганизмы оказываает ударная волна и ультрафиолетовое излучение разряда в жидкости. Обеззараживающее действие продолжается длительное время после прекращения разрядной обработки (сутки, недели и более), что вызвано действием продуктов разложения микроорганизмов в активной фазе процесса. Явно выраженное бактерицидное действие на микробную клетку отмечается при энергии разряда (0.6-0.8)*102 Дж.
Литература.
1. Кутепов А.М., Захаров А.Г., Максимов А.И. Растворы и плазма, Наука в России, №5(107), 1998, с. 11-13.
2. Академик А.М. Кутепов, А.Г. Захаров, А.И. Максимов Проблемы и перспективы исследований активируемых плазмой технологических процессов в растворах Доклады Академии Наук , 1997, том 357, №6, с. 782-786.
3. Hickling A., Ingram M.D. Glow-discharge electrolysis (review). Journ. Electroanalytical Chemistry, 1964, V.8, 65-81.
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |