Школа по плазмохимии
для молодых ученых России и стран
СНГ
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
ИССЛЕДОВАНИЕ
МЕХАНИЗМОВ ОБРАЗОВАНИЯ И ГИБЕЛИ
АТОМОВ В ПЛАЗМЕ
СМЕСИ ХЛОРА С КИСЛОРОДОМ
Скородумов
А.Е., Ситанов Д.В.
Ивановский
химико-технологический
университет
В настоящее время
для травления тугоплавких
металлов, алюминия, сложных
полупроводников применяется
плазма хлора и его производных..
Поэтому вопросы, связанные с
изучением кинетики и механизмов
образования активных частиц в
плазме хлора с кислородом являются
актуальными.
Разрядная трубка
представляла собой цилиндр из
молибденового стекла длиной 350 мм и
внутренним диаметром 18 мм.
Электроды (анод из хрома и катод из
бериллия) располагались в
вертикальных боковых отростках.
Хлор получали термическим
разложением прокаленной соли CuCl2 непосредственно в
вакуумной системе, давление
контролировалось U-образным масленым
манометром, а расход капиллярным
масленым реометром. С целью
выявления характера влияния
кислорода на скорость образования
атомов хлора в тлеющем разряде
пониженного давления в ходе
эксперимента поддерживалось
неизменное общее давление в
системе 100 Па и плотность тока 4,5.
10-3 мА/см2.
Концентрация
молекул хлора определялась методом
абсорбционной спектроскопии
описанным в работе [2] . В качестве источника
облучения
использовалась
лампа с полым катодом на серебре
(ЛСП-1) с резонансной линией
излучения 328 нм. Прошедшее через
разрядник излучение
фокусировалось на входной щели
монохроматора МУМ-1, в качестве
приемника излучения использовался
фотоэлектронный умножитель ФЭУ-79.
Сигнал с фотоэлектронного
умножителя подавался на усилитель
постоянного тока Ф-116/2, а с него на
записывающее устройство КСП-4.
 Относительная
концентрация атомов кислорода
определялась методом оптической
эмиссионной спектроскопии.
Соответствующие коэффициенты
скоростей возбуждения вычислялись
путем численного решения
кинетического уравнения Больцмана
на ЭВМ. Напряженность поля
измерялась путем компенсации тока
в цепи электростатических зондов,
помещенных в область
положительного столба тлеющего
разряда постоянного тока.
Температура в разряде
контролировалась методом двух
термопар. Общая концентрация
частиц в плазме (N0) определялась по
уравнению состояния идеального
газа.
Относительная
концентрация атомов кислорода
определялась методом оптической
эмиссионной спектроскопии.
Соответствующие коэффициенты
скоростей возбуждения вычислялись
путем численного решения
кинетического уравнения Больцмана
на ЭВМ. Напряженность поля
измерялась путем компенсации тока
в цепи электростатических зондов,
помещенных в область
положительного столба тлеющего
разряда постоянного тока.
Температура в разряде
контролировалась методом двух
термопар. Общая концентрация
частиц в плазме (N0) определялась по
уравнению состояния идеального
газа.
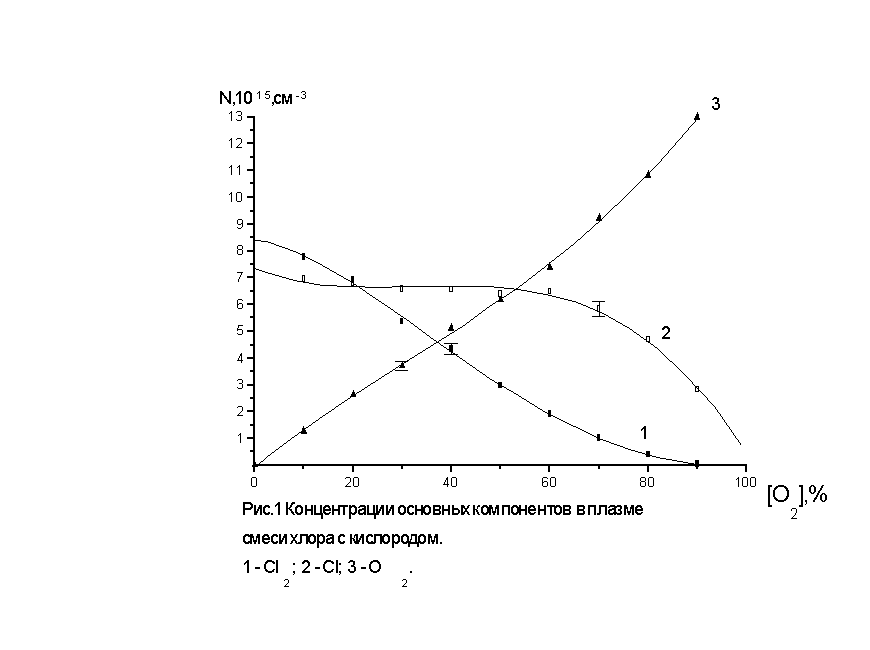
На рис.1 приведены
экспериментальные данные по
концентрации основных частиц для
плазмы смеси хлора с кислородом в
зависимости отпроцентного
содержания кислорода. Как видно из рис.1
уменьшение концентрации молекул
хлора идет быстрее, чем по
линейному закону. Следовательно
кислород нельзя рассматривать как
пассивный разбавитель хлора.
Введение кислорода в зону разряда
должно приводить к дополнительной
диссоциации молекул хлора. Этот
факт определяет характер поведения
концентрации атомов хлора,
образующихся в разряде. Из рис.1
видно, что почти до 70% содержания
кислорода в плазме концентрация их
изменяется незначительно. Этот
экспериментальный факт делает
весьма перспективным
использование смесей хлора с
кислородом в технологических
процессах, где требуется
повышенный выход атомарного хлора.
Однако, для надежного предсказания
результатов плазмохимических
реакций необходимо четко
представлять механизмы, приводящие
к образованию и гибели атомов хлора
в зоне разряда. В данной статье
будут проанализированы раз- личные факторы,
влияющие на скорость образования и
гибели атомов хлора в плазме с
добавками кислорода.
Из литературы [3]
известно, что
основными процессами приводящими к
диссоциации молекул хлора при
взаимодействии с электронами
являются:
а). прямая
диссоциация молекул хлора при
электронном ударе:
Cl2 + e ® Cl + Cl + e
(1)
б). диссоциативное
прилипание электронов к молекуле
хлора:
Cl2 + e ® Cl2-
® Сl +
Cl- (2)
Данные по
концентрация электронов (Ne), их средней энергии (Еср)
и приведенной напряженности
электрического поля (E/N0) и температуре газа (Тг),
вычисленные
коэффициенты прямой скорости
диссоциации Cl2 под действием
электронного удара (Кд) и
диссоциативного прилипания
электронов к молекулам хлора (Кдп),
суммарная скорость этих процессов
(Где) приведены в
таблице №1.
Таблица №1
| [O2], %
|
Тr, K |
E/N0,
10-15, В.
см2 |
Еср, ЭВ
|
Ne, 108, см-3
|
Кдп, 10-10,
см3/c
|
Кд, 10-9,
см3/с
|
Где, 1015,
см-3. с-1
|
| 0 |
469 |
2,79 |
4,68 |
5,62 |
2,11 |
6,02 |
29,4 |
| 10 |
457 |
2,34 |
4,30 |
7,19 |
2,12 |
5,69 |
32,9 |
| 20 |
449 |
2,21 |
4,35 |
7,63 |
2,15 |
5,84 |
31,9 |
| 30 |
465 |
2,29 |
4,74 |
7,20 |
2,18 |
6,44 |
25,8 |
| 40 |
458 |
2,22 |
4,97 |
7,19 |
2,22 |
6,89 |
22,2 |
| 50 |
470 |
2,19 |
5,34 |
7,00 |
2,27 |
7,53 |
16,0 |
| 60 |
453 |
2,03 |
5,55 |
7,11 |
2,32 |
8,05 |
11,2 |
| 70 |
454 |
1,84 |
5,60 |
7,66 |
2,40 |
8,46 |
6,9 |
| 80 |
459 |
1,88 |
5,89 |
7,56 |
2,43 |
8,94 |
2,6 |
| 90 |
460 |
1,78 |
5,81 |
8,28 |
2,50 |
9,03 |
0,2 |
Решение
кинетического уравнения Больцмана
производилось без учета
диссоциации кислорода. Такой
расчет является достаточно точным,
так как сравнение результатов
решения без учета диссоциации
кислорода и в предположении, что
степень диссоциации равна 10% дали
малоотличимые результаты.
Из таблицы №1
видно, что коэффициенты скорости
диссоциативного прилипания хотя и
увеличиваются, с увеличением
процентного содержания добавки, но
во всех случаях остаются на порядок
величины меньше коэффициентов
скорости прямой диссоциации
молекул хлора. Этот факт с учетом
механизмов этих процессов (1 и 2)
позволяет заключить, что прямая
диссоциация Cl2 вносит основной вклад
в образование атомов хлора в
разряде. Вклад механизма
диссоциативного прилипания
электронов к молекуле С12, по сравнению с прямой
диссоциацией молекул хлора
оценивается на уровне 3%.
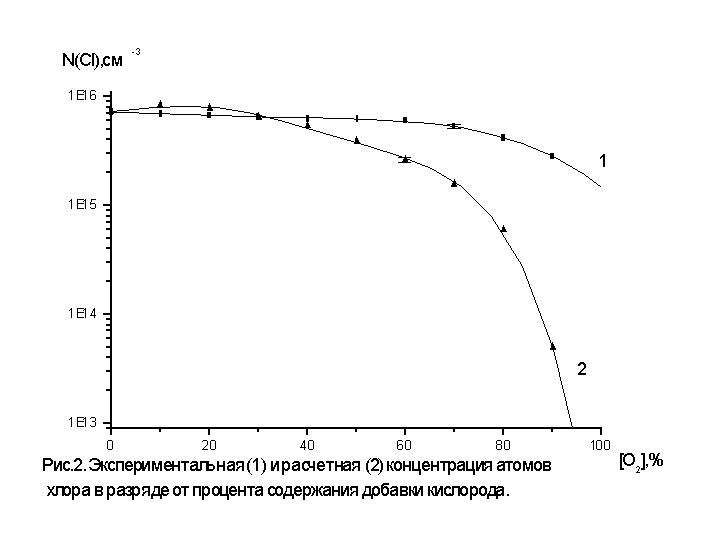 На рис.2 приведены
экспериментальная и рассчитанная
концентрации атомов хлора в
разряде. Последняя получена в
предположении, что коэффициент
скорости гетерогенной гибели
атомов хлора (Кг=8,13 с-1) для различных
составов плазмообразующего газа не
меняется и с учетом изменения
электрофизических параметров
плазмы. Из таблицы №2 видно, что при
увеличении процентного содержания
кислорода в смеси
плазмообразующего газа происходит
рост концентрации электронов в
разряде, ответственных за
диссоциацию молекул хлора по
механизмам 1 и 2. Подобный характер
поведения электронов в плазме
скорей всего объясняется
изменением вероятности их гибели
на стенке разрядной трубки .
Изменение же приведенной
напряженности электрического поля
является вторичным фактором
поддержания баланса заряженных
частиц в плазме.
На рис.2 приведены
экспериментальная и рассчитанная
концентрации атомов хлора в
разряде. Последняя получена в
предположении, что коэффициент
скорости гетерогенной гибели
атомов хлора (Кг=8,13 с-1) для различных
составов плазмообразующего газа не
меняется и с учетом изменения
электрофизических параметров
плазмы. Из таблицы №2 видно, что при
увеличении процентного содержания
кислорода в смеси
плазмообразующего газа происходит
рост концентрации электронов в
разряде, ответственных за
диссоциацию молекул хлора по
механизмам 1 и 2. Подобный характер
поведения электронов в плазме
скорей всего объясняется
изменением вероятности их гибели
на стенке разрядной трубки .
Изменение же приведенной
напряженности электрического поля
является вторичным фактором
поддержания баланса заряженных
частиц в плазме.
Из рис.2 видно, что
зависимость расчетной
концентрации атомов хлора при
больших долях добавки кислорода
лежит намного ниже
экспериментальной зависимости
полученной методом абсорбционной
спектроскопии. Причину этого
следует искать в процессах идущих в
плазме без участия электронов.
Такими процессами являются
процессы ион-ионной рекомбинации и
процессы с участием активированных
частиц кислорода. Рассмотрим эти
процессы более подробно.
Известно, что в
плазме хлора ионная компонента
представлена в основном частицами
С12+ [4], образующихся в
результате прямой ионнизации
молекул хлора ионами С1- [5], получающимися в
результате диссоциативного
прилипания электронов к молекуле С12. Таким образом, один
акт диссоциативного прилипания с
последующей ион-ионной
рекомбинацией
Cl2+ + Cl- 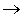 3Cl (3)
3Cl (3)
позволяет
получить в объеме плазмы четыре
атома хлора. Из механизма 3 видно,
что скорость ион-ионной
рекомбинации не будет превышать
скорости реакции 2 в результате
которой появляются ионы С1-.
Кроме того, из рис.1
видно, что концентрация молекул
хлора резко снижается.
Из этого следует, что колличество
актов ее ионизации также будет
резко убывать, что проявится в
снижении скорости ион-ионной
рекомбинации при увеличении
содержания кислорода в плазме.
Таким образом механизм ион-ионной
рекомбинации вносит
незначительный вклад в общую
концентрацию атомов хлора в
разряде. Объяснение отличия
экспериментальной и расчетной
концентрации атомов хлора следует
искать во взаимодействии с
активными частицами добавки.
В литературе
встречаются следующие механизмы
влияния добавки кислорода на
скорость образования атомов хлора.
1). Через
образование кислородсодержащих
радикалов, которые способствуют
выделению атомарного хлора в
результате следующих процессов.
Сl2 + O ® Cl + ClO (4)
ClO ® Cl + O (5)
ClO + O ® CL + O2 (6)
Возможность
самопроизвольного разложения ClO
высказанная в работе [1] вызывает
сомнение, так как в результате
реакции 4,5 происходит разложение
молекул хлора, а кислород является
только катализатором, однако
энергия Гиббса для этого процесса
при данных температурах будет
величиной отрицательной, что
говорит о невозможности
самопроизвольного протекания
процесса. Данный процесс может
протекать только при электронном
ударе. Протекание реакции по схеме
4,6 возможно и будет играть
значительную роль при образовании
атомов в разряде при условии, что
гомогенная гибель атомов кислорода
значительно увеличится. На рис.3
приведены экспериментальная
(измеренная методом эмиссионной
спектроскопии) и расчетная
(вычисленная по коэффициенту
диссоциации молекул кислорода
прямым электронным ударом)
концентрации атомов кислорода,
приведенные к аналогичным данным
для плазмы чистого кислорода.
Данные для расчета приведены в
таблице №2, где K(777) и I(777)
коэффициент возбуждения и
интенсивность линии кислорода с
длинной волны 777 нм, а Kде(О2) и Г(О2)е коэффициент
скорости диссоциации и скорость
диссоциации молекул кислорода
прямым электронным ударом.
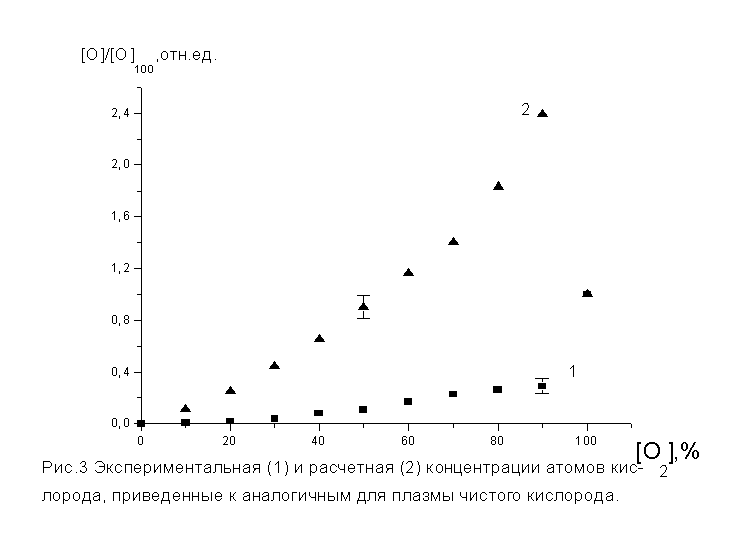 Таблица №2
Таблица №2
| [O2], %
|
K(777), 10-10,
см3.с-1
|
I(777), Отн.eд.
|
Kде(О2), 10-9,
см3. С-1
|
Г(О2)е, 1015,
см-3. с-1
|
К(A3S u+), 10-9,
см3/с
|
Г(A3S u+), 1015,
см-3. С-1
|
| 10 |
1,44 |
15 |
0,761 |
0,689 |
1,10 |
1,00 |
| 20 |
1,43 |
30 |
0,749 |
1,493 |
1,13 |
2,26 |
| 30 |
1,87 |
70 |
0,960 |
2,629 |
1,35 |
3,71 |
| 40 |
2,07 |
135 |
1,059 |
3,897 |
1,50 |
5,51 |
| 50 |
2,44 |
220 |
1,246 |
5,405 |
1,72 |
7,47 |
| 60 |
2,53 |
370 |
1,278 |
6,996 |
1,86 |
10,19 |
| 70 |
2,39 |
500 |
1,196 |
8,430 |
1,92 |
13,70 |
| 80 |
2,69 |
630 |
1,351 |
11,03 |
2,10 |
17,60 |
| 90 |
2,43 |
700 |
1,210 |
14,42 |
2,05 |
21,87 |
| 100 |
0,362 |
760 |
0,218 |
6,02 |
0,95 |
20,76 |
Из рис.3 видно, что
расчетная зависимость приведенной
концентрации атомов кислорода
располагаеся намного выше
экспериментальной. Это
свидетельствует о том, что в плазме
хлора с кислородом имеется
дополнительный механизм гибели
атомов кислорода, которого нет в
плазме чистого кислорода. Таким
образом в плазме смеси хлора с
кислородом должны протекать
плазмохимические реакции,
приводящие к убыли атомарного
кислорода в объеме реактора. Из
рассмотренных выше процессов
наиболее вероятными оказываются 4 и
6. С другой стороны эти процессы
можно рассматривать как
дополнительные каналы приводящие к
диссоциации С12 и накоплению в объеме
реактора атомарного хлора,
особенно при процентном содержании
кислорода в смеси
плазмообразующего газа выше 50%.
2). Вторым наиболее
вероятным процессом ступенчатой
диссоциации С12 можно рассматривать
их взаимодействие с метастабильным
кислородом A3S
u+ по
механизму:
O2(A3S
u+) + Cl2 ® O2(Х3S g-)
+ Cl2*
Cl2* ® Cl +
Cl (7)
Известно, что
большая часть метастабилей
кислорода образуется в результате
прямого электронного удара [7],
поэтому ддя того, чтобы оценить
возможный вклад процессов 7 в общую
диссоциацию Cl2 были расчитаны
скорости их образования при
электронном ударе. В таблице №2
приведены коэффициенты скорости
образования и сами скорости
образования метастабилей
кислорода A3S
u+
при электронном ударе в
зависимости от процентного
содержания кислорода в смеси.
Как видно,
скорость образования метастабилей
одного порядка со скоростью
диссоциации атомов хлора под
действием электронов Где,
а начиная с 70% содержания кислорода
в смеси даже превосходит ее. Это
позволяет рассматривать данный
канал диссоциации С12 при большом
содержании кислорода в смеси, как
конкурирующий с прямой
диссоциацией С12 при электронном ударе.
Известно, что наряду с протеканием
реакции 7 в условиях положительного
столба тлеющего разряда возможна
также объемная гибель метастабилей
кислорода при их взаимодействии с
атомами кислорода:
O2(A3S
u+) + О
®
O2(Х3S g-)
+ O (8)
Согласно [7] коэффициенты скорости
процесса 8 достаточно велики.
Однако, из таблицы №5 видно, что
скорость образования метастабилей
при 90 и 100 процентном содержании
кислорода примерно равны, в то
время как на рис.3 показано, что
экспериментальная концентрация
атомов кислорода при 100% кислорода в
смеси более чем в три раза
превышает концентрацию атомов
кислорода при 90% содержании
кислорода. Данный факт указывает на
то, что объемная гибель
метастабилей кислорода будет
протекать преимущественно по
механизму 7 и его можно
рассматривать как канал
диссоциации С12 уже при 40% содержании
кислорода в смеси
плазмообразующего газа.
В качестве еще
одного вклада в концентрацию
атомов хлора определенную методом
абсорбционной спетроскопии можно
считать образование в разряде
оксидов хлора и образованных из них
радикалов ClO,
которые методом абсорбционной
спектроскопии определяются как
атомы хлора. Оксиды
хлора образуются в результате
следующих реакций:
Cl2 + O 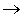 Cl2O
Cl2O
O2 + Cl 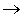 ClO2
ClO2
В условиях
низкотемпературной газовой плазмы
под действием активных частиц
плазмы они также могут распадаться
с образованием атомов хлора.
БИБЛИОГРАФИЯ
- Burton R.N., Smolinski G.. CCl4 and Cl2
Plasma Etching of 111-V Semiconductors and the Role of
added O2 // J. Electrochem. Society. 1982.
V.129. №7. P.
1599-1604.
- Ситанов Д.В.,
Светцов В.И., Чернявский С.Р.,
Исляйкин А.М.. Об измерении
концентрации атомов и молекул
хлора и брома в разряде методом
абсорбционной спектроскопии. /
Иван. хим. техн. акад. Иваново,
1994. Деп. в ВИНИТИ г.Черкассы,
№372-В94 от 10.02.1994.
- Куприяновская
А.П., Светцов В.И.. Механизм
образования и разрушения
активных частиц в галогенной
плазме //
Изв. Вузов. Химия и хим.
технология. 1983. Т. 26. №12. С. 1440-1444.
- Donelly V.M., Flamm D.L., Gollins G.. Lazer diagnostiks
of plasma etching: measurement of Cl2+
in a chlorine discharge // J. Vac. Sci. Technol. 1982.
V.21. №3. P.
817-823.
- Kurepa M.B., Belic D.S.. Electron-chlorin molecula total
ionisation and electron attachment cross section // J.
Phys. B. Atom and molec. Phys. 1978. V.11. №21. P. 3719-3731
- Бирюков А.С.,
Волков А.Ю., Шелепин Л.А.. Метастабильные
электронные состояния молекул
и газовые лазеры видимого
диапазона // Квантовая
электроника. 1976. T.3. №2. C. 321-329.
[ О Школе|Лекции|Секция 1|Секция 2|Секция 3|Секция 4|Секция 5|Cодержание |
 Относительная
концентрация атомов кислорода
определялась методом оптической
эмиссионной спектроскопии.
Соответствующие коэффициенты
скоростей возбуждения вычислялись
путем численного решения
кинетического уравнения Больцмана
на ЭВМ. Напряженность поля
измерялась путем компенсации тока
в цепи электростатических зондов,
помещенных в область
положительного столба тлеющего
разряда постоянного тока.
Температура в разряде
контролировалась методом двух
термопар. Общая концентрация
частиц в плазме (N0) определялась по
уравнению состояния идеального
газа.
Относительная
концентрация атомов кислорода
определялась методом оптической
эмиссионной спектроскопии.
Соответствующие коэффициенты
скоростей возбуждения вычислялись
путем численного решения
кинетического уравнения Больцмана
на ЭВМ. Напряженность поля
измерялась путем компенсации тока
в цепи электростатических зондов,
помещенных в область
положительного столба тлеющего
разряда постоянного тока.
Температура в разряде
контролировалась методом двух
термопар. Общая концентрация
частиц в плазме (N0) определялась по
уравнению состояния идеального
газа.  На рис.2 приведены
экспериментальная и рассчитанная
концентрации атомов хлора в
разряде. Последняя получена в
предположении, что коэффициент
скорости гетерогенной гибели
атомов хлора (Кг=8,13 с-1) для различных
составов плазмообразующего газа не
меняется и с учетом изменения
электрофизических параметров
плазмы. Из таблицы №2 видно, что при
увеличении процентного содержания
кислорода в смеси
плазмообразующего газа происходит
рост концентрации электронов в
разряде, ответственных за
диссоциацию молекул хлора по
механизмам 1 и 2. Подобный характер
поведения электронов в плазме
скорей всего объясняется
изменением вероятности их гибели
на стенке разрядной трубки .
Изменение же приведенной
напряженности электрического поля
является вторичным фактором
поддержания баланса заряженных
частиц в плазме.
На рис.2 приведены
экспериментальная и рассчитанная
концентрации атомов хлора в
разряде. Последняя получена в
предположении, что коэффициент
скорости гетерогенной гибели
атомов хлора (Кг=8,13 с-1) для различных
составов плазмообразующего газа не
меняется и с учетом изменения
электрофизических параметров
плазмы. Из таблицы №2 видно, что при
увеличении процентного содержания
кислорода в смеси
плазмообразующего газа происходит
рост концентрации электронов в
разряде, ответственных за
диссоциацию молекул хлора по
механизмам 1 и 2. Подобный характер
поведения электронов в плазме
скорей всего объясняется
изменением вероятности их гибели
на стенке разрядной трубки .
Изменение же приведенной
напряженности электрического поля
является вторичным фактором
поддержания баланса заряженных
частиц в плазме.  Таблица №2
Таблица №2